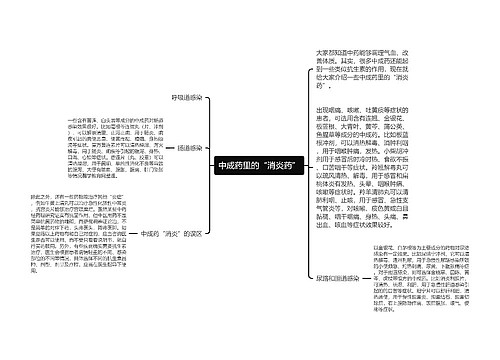
4、对经销假劣药品问题的核查,必须查明企业在经销药品过程中有无违规行为。如无违规行为,可将相关核查资料与认证申请一并报送;如有违规行为,则应进行6个月整改,期满后重新申请认证。
1、市药品监督管理局市场监督处在收到认证申请及资料之日起10个工作日内进行形式审查。审查结束后,将是否受理的意见填入认证申请书,并于3日内以书面形式通知申请认证企业。对同意受理的认证申请,市药品监督管理局应在通知企业的同时,将认证申请书及资料转送认证中心。不同意受理的,告知应说明原因附驳回通知书。
2、认证中心应在收到认证申请书及资料的15个工作日内进行认证申请书及资料的技术审查。技术审查主要对申请企业申报资料的内容根据法规和GSP标准对申请企业进行审查。
3、对认证申请书和资料中有疑问的,应通过所在地药品监督管理分局与企业接洽,限期并按要求予以说明或补充资料。逾期仍不符合要求的,提请市药品监督管理局驳回申请。对符合要求的,组织制定现场检查方案以及收费通知书、现场检查通知书等。
1、对通过技术审查的企业,认证中心应在15个工作日内组织对其进行现场检查。检查前,应将现场检查通知书(式样见附件十一)提前5个工作日发至被检查企业,同时抄送市药品监督管理局。
2、认证中心对通过技术审查的企业,根据认证的申请制定现场检查方案,基本内容包括:认证基本情况、认证范围、日程安排、检查项目、检查组成员及分工等,并在技术审查中发现并需要现场核实的问题列入方案。
3、认证中心负责将现场检查通知书发至被检查企业,并抄送市局市场监督处、申请企业所在地药品监督管理分局、检查组成员所在单位。
4、现场检查实行检查员回避制度。检查组成员应国家药品监督管理局药品GSP认证检查员库中的检查员,经随机抽取组长1人、组员2人组成现场检查实行组长负责制。
5、现场检查时间,一般为药品批发企业2至4天,药品零售连锁企业3至4天,零售企业1至2天。
6、首次会议由组长主持,介绍检查组成员,宣读检查纪律、检查方案,核实企业有无违规经营假劣药品情况(表格式样见附件十二),说明检查注意事项,落实检查日程,确认检查陪同人员等。
7、检查组须按照检查评定标准对企业进行全面的认证检查,认真填写认证现场检查记录(式样见附件十三),检查中发现的不合格项目如实记录;由组长组织评定汇总,做出综合评定结果,撰写现场检查报告(式样见附件十四)。评定汇总期间,被检查企业人员应回避。
8、现场检查结束后,检查组应提交现场检查报告,双方应对结果进行签字确认。现场检查报告应由检查组全体人员签字,并附不合格项目情况表(式样见附件十五)、检查员记录。如企业对检查结果产生异议,可向检查组提出说明或做出解释。如双方未能达成共识,检查组应对异议内容予以记录,与检查报告等有关资料一并送交认证中心。
9、末次会议检查组宣读综合评定结果。被检查企业可安排有关人员参加。不合格项目情况表须经检查组全体成员及被检查企业负责人签字后,双方各执一份。
10、检查组在完成检查后应及时将现场检查报告及相关资料提交认证中心。
1、根据检查组现场检查报告并结合有关情况,认证中心在收到现场检查报告的10个工作日内,汇总技术审查等的情况提出审查结果,送交市药品监督管理局审批。
2、市药品监督管理局在收到审核意见之日起15个工作日内,做出认证是否合格或限期整改的结论。限期整改的,应书面通知申请企业(表格样式见附件十六)。
3、被要求限期整改的企业,应在接到通知的3个月内向市药品监督管理局和认证中心报送整改报告,提出复查申请。认证中心应在收到复查申请的15个工作日内组织检查组进行复查。超过规定期限未提出复查申请或经过复查仍未通过现场检查的,将被确定为认证不合格。
4、对认证合格的企业,市药品监督管理局应在做出结论的5个工作日内将有关情况告知国家药品监督管理局,并颁发《药品经营质量管理规范认证证书》(国家药品监督管理局统一印制)。
5、对认证不合格的企业,市药品监督管理局应书面通知企业。企业可在通知下发之日6个月后,重新申请GSP认证。
1、市药品监督管理局以及各分局对认证合格的药品经营企业进行监督检查,以监督认证合格企业是否持续符合认证标准。监督检查包括跟踪检查、日常抽查和专项检查三种形式。
2、市药品监督管理局应在企业认证合格后12个月内,对其认证的药品经营企业进行一次跟踪检查,检查企业质量管理的运行状况和认证检查中出现问题的整改情况。
3、各级药品监督管理部门应结合日常监督管理工作,定期对辖区内认证合格企业进行一定比例的抽查,检查企业是否能按照GSP的规定从事药品经营活动。

 U453440030
U453440030
 U429508237
U429508237