制剂科室职责与人员设置思维导图
青衣衫
2023-02-21

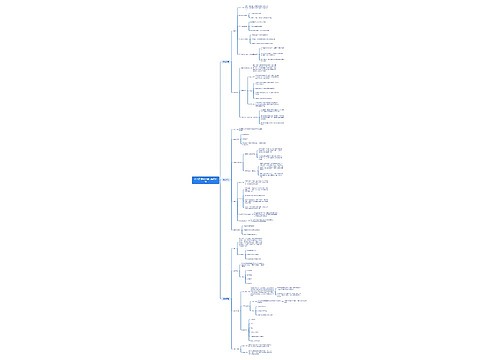
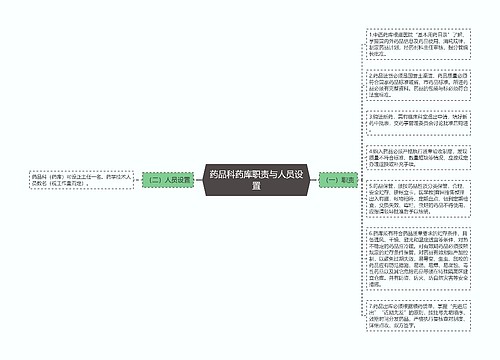
(一)职责 1.配制各种制剂必须有详细的工艺规程、质量标准、批准手续、对制剂的质量要求,收载药典或地方标准的制剂质量必须符合法定文献要求,药典或地方标准以外的制剂质量必须符合操作规程的要求,该操作规程由配制单位撰拟,经卫生行政部门批准。 2.各种制剂室必须建立健全以保证制剂质量的规章制度。
树图思维导图提供《制剂科室职责与人员设置》在线思维导图免费制作,点击“编辑”按钮,可对《制剂科室职责与人员设置》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:4eb2bc027dd3d8554ceac91af756871b
思维导图大纲
相关思维导图模版
9.战斗的基督教思维导图
 U582679646
U582679646树图思维导图提供《9.战斗的基督教》在线思维导图免费制作,点击“编辑”按钮,可对《9.战斗的基督教》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:33d168acd0cd9f767f809c7a5df86e3a
第六章 群体传播与组织传播_副本思维导图
 U882673919
U882673919树图思维导图提供《第六章 群体传播与组织传播_副本》在线思维导图免费制作,点击“编辑”按钮,可对《第六章 群体传播与组织传播_副本》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:1672f555831e7d9a3bb2cf2fb792cb49