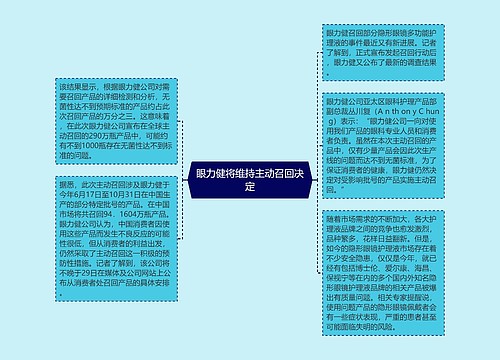
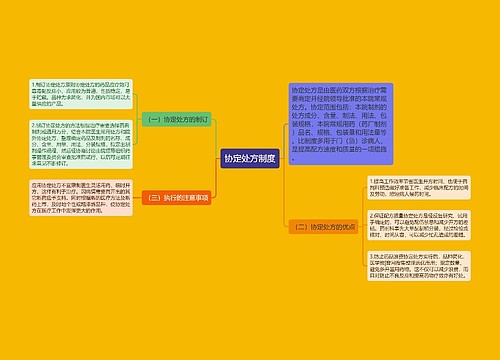
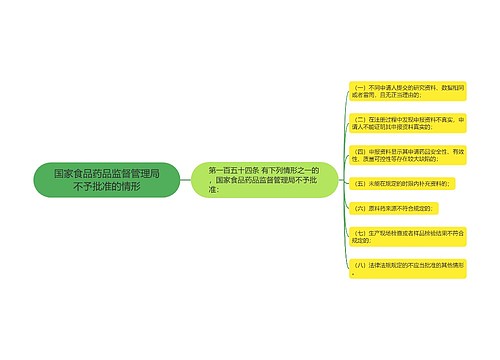
召回首向医疗器械“开刀”思维导图
失落感
2023-02-21

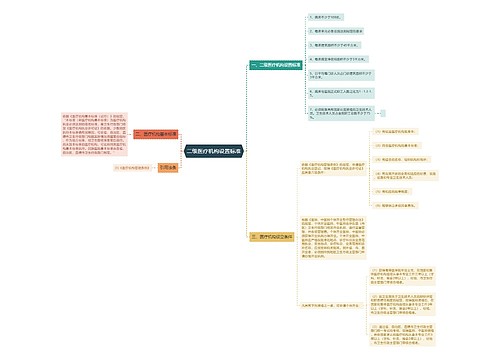
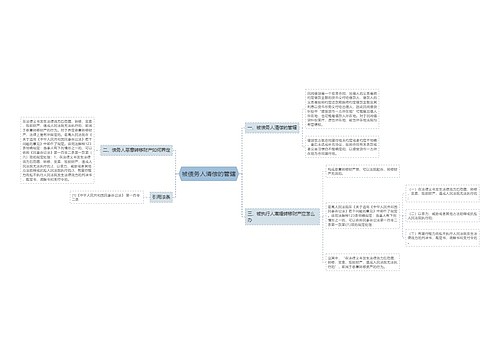
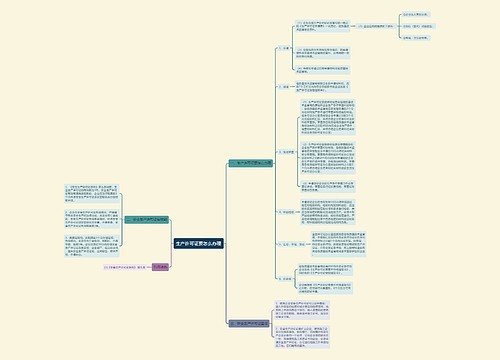
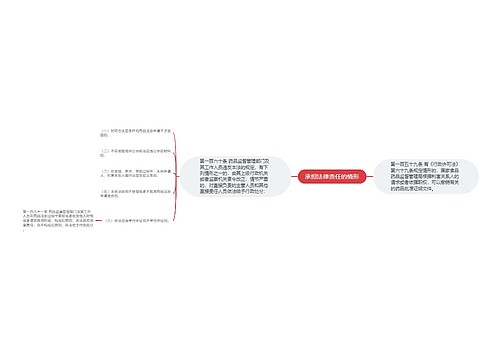
我国医药行业从未有召回制度的历史将改写
树图思维导图提供《召回首向医疗器械“开刀”》在线思维导图免费制作,点击“编辑”按钮,可对《召回首向医疗器械“开刀”》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:975e45337e7fd069b668933a56c1fd7f
思维导图大纲
相关思维导图模版
一、研究内容思维导图
 U682687144
U682687144树图思维导图提供《一、研究内容》在线思维导图免费制作,点击“编辑”按钮,可对《一、研究内容》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:4f21797dd3e8b08f1951dfc24e7be94f
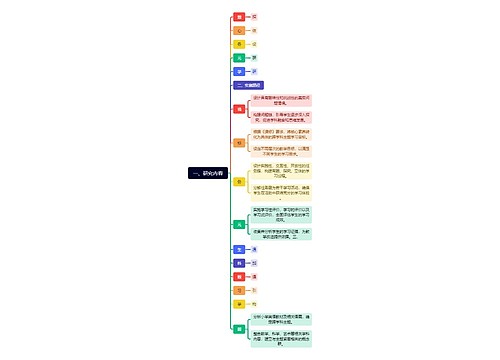
904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查思维导图
 U633687664
U633687664树图思维导图提供《904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查》在线思维导图免费制作,点击“编辑”按钮,可对《904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:10b9a8a2dd2fb4593f8130ef16c320fc