关于正式IND提交到正式批准需要多久时间,根据2018年《
“在我国申报药物临床试验的,自申请受理并缴费之日起60日内,申请人未收到国家食品药品监督管理总局药品审评中心(以下简称药审中心)否定或质疑意见的,可按照提交的方案开展药物临床试验。”
这里的日,指的是工作日。60个工作日按照一个月大约21-22天来算的话,大概不到3个月的时间,也就大概地记忆为3个月左右时间。
那这3个月或者说60个工作日,PM能推进试验到什么程度呢?是否可以完成入组第1例病人这个里程碑呢?毕竟方案,知情同意书之类的都已经定稿了?
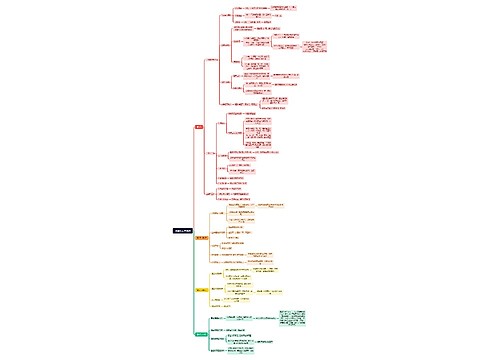
要明确在正式IND提交后PM要做的工作,简单来说就下面几个大的目标:
是否能完成入组第1例病人这个里程碑,我们需要看看完成这个里程碑,我们需要完成什么事项,主要有以下几项:
IND批件就不说了,如果没有意外或特殊,应该就可以在3个月后得到批准,毕竟在正式让你提交之前一般情况下会要跟CDE进行一个沟通交流会,基本上CDE的态度就能初步明了。另外一个维度是组长单位的立项,伦理,合同签署,在这个阶段,由于后期很多分中心都是需要组长单位的伦理审批件,能否快速完成首例入组主要就是看组长单位,要想快速完成这个目标,理论上来说,一个重要的前置条件就是组长单位需要在没有IND批件的情况下,同意伦理前置。
另外就是立项后,伦理审批与合同审阅与商谈在组长单位是否能够并行。理论上来说,其实是不影响的,毕竟一个伦理的活,一个是机构的活,而且很多医院均开始了同步,但是明确在问清组长单位是否同意,以什么情况下同意,也是非常重要的,毕竟原则是原则,操作细则又是操作细则。
这个时候未雨绸缪地在确认组长单位时就前期了解组长单位立项,伦理与合同流程,甚至在方案起草一旦确认组长单位后就去了解会对IND正式提交后相应的立项,伦理与合同等的流程有很大的帮助。
另外一个小技巧就是方案起草阶段一旦确定了组长单位,就可以着手要相关有经验的CRA前期去与机构办建立联系,了解流程了,毕竟,申办方可能在前期与牵头PI会就方案有多次联系或开会,但是机构办常常被忽略,这时就需要PM及时具备这个意识,从现在开始联系,减少后期立项时的阻碍。
PM也就可以在方案起草阶段相应地准备组长单位立项需要的各种文件了。CRA也可以在方案讨论阶段,提前把PI相关资质文件,授权文档在前期一并收集过来,一旦正式递交,PM只需要按终稿的方案修改相应的文件即可,同时CRA也只需要更新研究中心需要特殊文件即可。
还有一点需要特别提醒的就是保险与病例报告表,其实这两件文件地方案摘要定稿后就可以开始请保险公司与数据部门或者请相应的CRO来进行设计了。保险公司需要的材料也不一定需要你完整的方案,一般方案摘要即可。而数据部门则可以根据同类项目先做一版CRF出来,届时等方案定稿再去修改细节。这块如果是没有自己数据部门的申办方,在前期快速地确定数据统计供应商,包括在方案讨论时就确定好,也把他们加入进来是最合适的,毕竟方案里关于统计部分的内容也是要统计撰写和把关的。
另外就是合同,其实合同主要是确定费用,在方案摘要里如果有完整的研究流程的话,这个时间就可以起草合同并启动内部审批流程,并与PI初步确认意向,以明确是否进行调整。前期做好这项工作,后面就直接可以递交研究中心了。
总结下,其实在方案摘要定稿后就可以着手准备,并在IND正式递交后就应该准备好了的事项如下:
这样就能做到在正式IND递交后第一时间将相应的立项资料递交上去,把最多的时间留给组长单位来完成它的相应立项,伦理与合同流程,让他们在3个月内完成所有的流程,就等IND批件。老实说,这是一个类似优秀的水平。研究中心特别优秀的除外。
正式拿到IND批件后,还要做的一件事尽快到CDE平台进行登记,当然如果需要到其他平台如clinicaltrial.gov等网站进行登记也需要在申请登记,与遗传办申请要同步进行。
研究中心这块明确后,我们还有一个准入门槛就是遗传办,当然,如果你的项目完全不需要遗传办,那下面的内容可以不看,但是如果你的项目是需要遗传办批准的话,那如何准备遗传办就很重要了。
首先要明确一点,遗传办申请书递交除了需要组长单位伦理批件以外,还需要IND批件。
啥意思,就是前面研究中心工作及申办方内部工作做得再超前,你正式递申请书的那一刻需要上传IND批件或默认许可。
拿到IND批件或默示许可后还不算完,还需要拿到各个合作单位包括组长单位的签章,如果要想快,前期组长单位签章流程必须了解得非常清楚,按常规一周能拿到,就已经算很快了。
这个时候你能才能算正式提交申请,再算上形式审批5个工作日,一般来说就是1-2周,没有问题你才能算是正式受理。
那正式受理需要多少久呢?我们简单看最近十期遗传办公示了解下:
可以看到受理到公示最短天数最快29天,最慢春节影响44天,平均35天,如果要算上最早的受理日期,最长天数可以加上12天左右,那就是平均35-47天,即正式受理到公示预计为1个月至1.5个月左右。
从拿到IND批件,加上合作单位签章1周,加上形式审查的1周,再正式受理到公示1-1.5个月,整体来说,最理想的情况,所有流程均一次性通过的情况,正常来说为1.5到2个月可以拿到遗传办批件。
这个时候,如果你的合同,药品,启动会,病人等其他所有内容都准备好了,就可以筛选和入组啦!!这时候距离你正式提交IND过去多久了?小手算算,差不多4.5到5个月了。
这其中提到了启动会与病人,这需要PI非常配合,而且需要同步所有的遗传办的进程,提前帮你留意符合要求的病人,这个说起来容易,但做起来是非常考验PM与CRA的能力的一环。
这其实就决定了分中心最早能动的时间就是IND批件拿到后,即分中心的立项,伦理与合同均可以在IND批件拿到后同步起动。
在IND正式提交后那PM能做什么呢,可以做以下两件事:
毕竟从IND正式提交到批准需要约3个月的时间,这段时间,就可以有效地组织起CRA团队去完成分中心成员的确定与相关分中心立项,伦理与合同流程的熟悉与评估。
如果安排得好的话,在正式IND批件下来,组长单位开始走遗传办的流程时,分中心完全可以走他们的立项,伦理与合同的流程,等遗传办批件下来,理想的话,按分中心3个月启动的时间算,与组长单位启动和入组病人时间可能也就相隔1-1.5个月时间,毕竟遗传办也需要差不多1.5-2个月的时间来批准。
当然这是很理想的分中心的情况,那PM在这个过程如何确认标准,如何选择中心,如何明确自己团队的入组目标,这些整体规划与评估能力是非常重要的。
供应商的选择其实我觉得在方案摘要定稿时就可以开始进行了,最好的情况是长期合作的供应商,这时就能把选择供应商,比价,比参数,审批这些内容做到最大程度的简化。
但是如果每个项目均要重新选择供应商,那PM要做好相应的规划。并做好相应的沟通与预算。一般来说,假如能意识到在正式IND之后就快速启动供应商的筛选,其实也不算晚,当然,如果你的组长单位的立项要求特别严格,比如说立项时就要要求把第三方实验室等都明确好,这个时候,最好是在方案摘要一定稿就选择供应商,在正式IND提交之后,所有的供应商都选择好了。
千万不要认为时间还早,毕竟供应商的选择一般涉及到金额较大,走流程审批,随便走走一个月都是快的,而事实上从摘要定稿到正式方案定稿并正式提交,一般也不会超过一个月。
当然,前期方案摘要会有很多东西没有明确或不确定,导致供应商无论在报价还是服务范围都不太确定,但是能在前期做好接触,一旦方案明确下来,即迅速报价与筛选,这也能极大地提高后面的速度。
拿EDC供应商举例,毕竟他们搭建EDC相对要比较好的情况下,可能需要2-3个月左右的时间,最好是能前期就选定,然后一旦IND正式提交,他们就可以开始搭建EDC的工作,有4-4.5个月左右的时间,就完全能在入组首例病人时,相关的系统上线。而不是前期不考虑,后面慌慌张张催进度。
各种项目管理计划的制定,这其实根据内部与外部相关功能部门一起来制订的,但是无论什么样的计划,均必须在首例入组前制定完毕。
当然,各种计划的制定由于只涉及内部或供应商,没有涉及研究中心,相对来说,时间上会好把控一点。但是最好也是在正式提交IND后,相关的计划就可以开始撰写起来了,一般来说,留1-2个月的时间把所有的计划起草及终稿,基本上也是来得及的。
整体来说,PM应该是从参与方案摘要审阅时就得自己做好后续的规划了,重要的节点,比如方案摘要定稿时我需要完成哪些事项,方案正式定稿我能完成哪些事项,IND正式递交后,我这期间要完成哪些事项,首例病人入组前,我要完成哪些事项,均要结合项目想得非常明白。这样才能在每个时间节点,非常清晰地知道自己要完成哪些事项,能与后续的事项圆满无缝地对接起来。做到又快又好地推进项目。

 U880271396
U880271396
 U281954995
U281954995