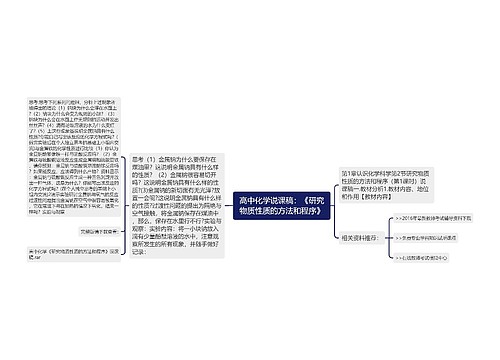
高中化学说课稿:《富集在海水中的元素——氯》思维导图
久别情深
2023-03-14

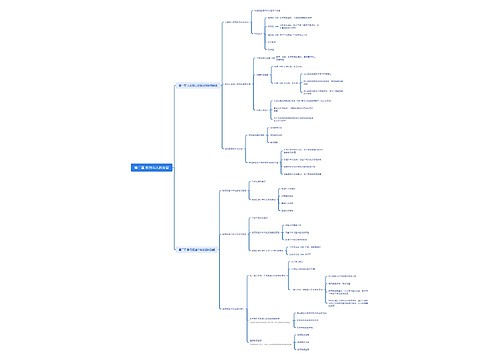
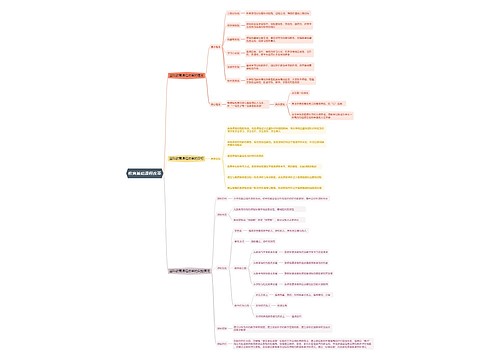
人教版化学必修1第四章非金属及其化合物第二节富集在海水中的元素——氯说课稿 四川省宜宾市第一中学校 田贵荣 各位评委,各位老师,大家好! 我是四川省宜宾市一中的田贵荣,今
树图思维导图提供《高中化学说课稿:《富集在海水中的元素——氯》》在线思维导图免费制作,点击“编辑”按钮,可对《高中化学说课稿:《富集在海水中的元素——氯》》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:95d0167a402aa2f467d6f6479742b16d
思维导图大纲
相关思维导图模版
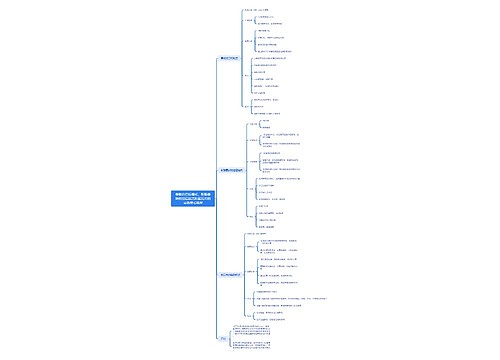
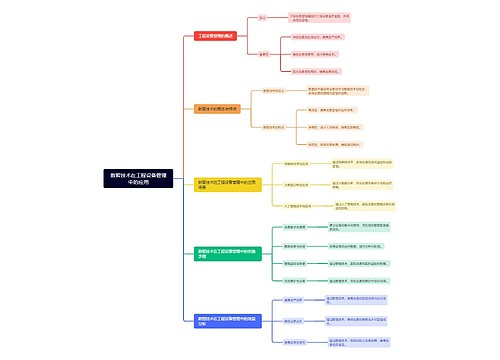
数智技术在工程设备管理中的应用思维导图
 U182637395
U182637395树图思维导图提供《数智技术在工程设备管理中的应用》在线思维导图免费制作,点击“编辑”按钮,可对《数智技术在工程设备管理中的应用》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:f9a2de84ad9a9ceebc96385d71be9ebe
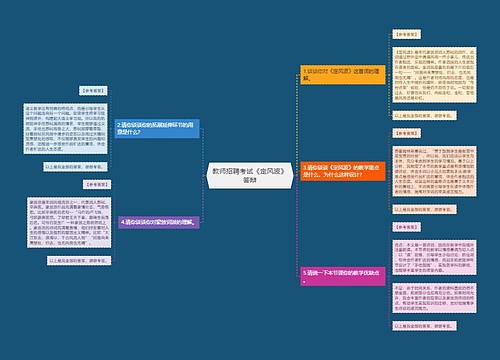
职业生涯人物访谈思维导图
 U381614141
U381614141树图思维导图提供《职业生涯人物访谈》在线思维导图免费制作,点击“编辑”按钮,可对《职业生涯人物访谈》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:c1f2e2bd2ea229fce3f9797aa82def65