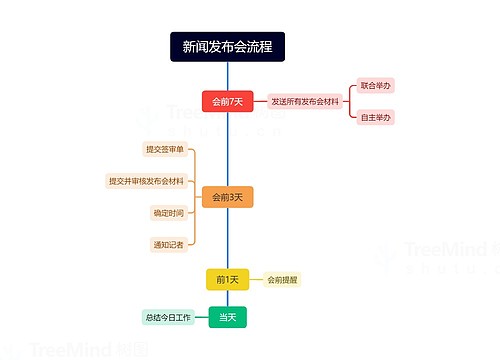
美国还有一种和专利保护并存、平行的知识产权保护形式,在新药批准时,FDA授予符合条件的药品一定期限的市场独占权。比如,对于新化学实体,无论其是否有专利存在,在这5年内,FDA不受理其仿制药的申请。如果是已批准的药品通过改变剂型、给药途径或使用条件而具备了新的适应证或用途,并经过了必要的新的临床试验(不包括生物等效性试验),FDA会在批准针对增加的新适应证或新用途提出的新药申请或补充申请时授予其3年的保护期。同时,美国为鼓励罕见病的药品研发,对获得“罕见病药”资格认定的罕见病药品授予7年的市场独占保护期,为了鼓励药品制造商进行儿科群体的临床研究,给予其6个月的市场保护期。另外,为了鼓励仿制药,美国对第一个挑战专利药成功者(即首仿药)给予180天的市场独占权。
“专利在创新方面是一个非常主要的保护,这样才能够把这些专利技术变成产品,最后能够上市来为病人服务,这是一个非常好的循环。”辉瑞公司高级副总裁、首席知识产权律师罗伊·沃尔德伦认为,通过这些措施,美国创造了很好适合创新的生态系统。这种体制保障了产品的安全性和有效性,不断鼓励创新和新药开发,并在医药市场上创造更多的竞争,推动创新药和仿制药并存。
然而有观点认为:美国的这些措施一方面确实鼓励了新药创制,尤其是罕见病药和儿科用药,并且促进了一大批中小企业的创新。但是由于给予了制药企业更大的利润,阻滞了低价仿制药的上市,造成了消费者药品支出的增长和医疗保险的压力增大。但另一方面,如果美国没有这些激励政策,企业就会缺乏研制新药的动力;市场上没有足够的新药供应,缺乏竞争仍然会导致某些药品价格居高不下,患者医疗救治途径的改善也毫无指望。