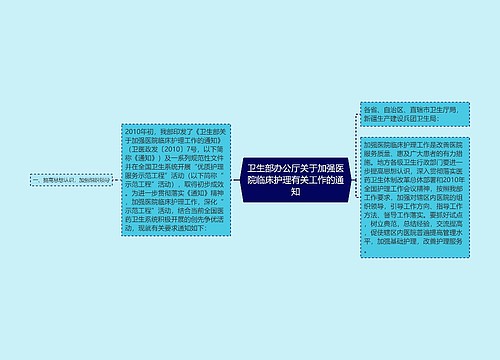
各省、自治区、直辖市食品药品监督管理局(药品监督管理局):
三磷酸胞苷二钠为辅酶类药,是核苷酸衍生物。目前国内已有数十家药品生产企业获得原料药、注射液、粉针的药品批准文号,尚有一些品种正在注册过程中。国家局发现已上市品种的说明书存在用法用量不统一、适应症表述宽泛等诸多问题。为了科学规范说明书,正确指导临床用药,国家局组织对三磷酸胞苷二钠制剂的说明书进行了修订,现将修订后的注射用三磷酸胞苷二钠和三磷酸胞苷二钠注射液说明书予以公布(见附件),并将有关事项通知如下:
一、该品适应症统一修订为“颅脑外伤后综合症及其后遗症的辅助治疗”。删除下列适应症,并说明如下:1.植物神经紊乱、神经官能症。植物神经紊乱、神经官能症现称为“神经症”,不需要静脉用药。2.心功能不全。心功能不全是许多心脏、其他疾病的终末阶段,目前尚无特效治疗,本品对窦房结有明显抑制作用,有加重心功能不全的可能,且本品无治疗心功能不全的依据。3.进行性心肌萎缩,不是疾病诊断名词。4.肝炎。不良反应、注意事项已经注明少数患者用药后出现一过性轻度谷丙转氨酶升高,肝肾功能不全者慎用,提示本品可能导致肝脏损害,且缺乏保肝、降酶等治疗肝炎的依据。
二、该品用法用量统一修订为:肌内注射,一次20mg,一日1~2次(20~40mg);静脉滴注,20mg加入5%葡萄糖注射液或者生理盐水250ml中,缓慢静脉滴注。
四、请通知本行政区域内的相关药品生产企业按照所附说明书样稿对药品说明书和包装标签进行修订。对于说明书样稿中的空项或未列全的项目,应要求企业根据实际情况填写。如规格、贮藏、包装、有效期、批准文号、生产企业等。
五、药品生产企业应按照上述要求尽快修订说明书和包装标签,并于本文件下发之日起40日内报所在地省级食品药品监督管理局备案。自备案之日起出厂的药品不得再使用原药品说明书和包装标签。
六、药品生产企业应当将修订的内容及时通知相关医疗机构、药品经营企业等单位和部门,并尽快对已出厂的该药品的说明书予以更换。由于未及时更换说明书而引起不良后果的,由药品生产企业负责。
七、国家局此前按照所附说明书样稿批准的药品不在上述要求之列。
附件:注射用三磷酸胞苷二钠、三磷酸胞苷二钠注射液说明书
【药品名称】通用名:注射用三磷酸胞苷二钠英文名:Cytidine Disodium Triphosphate for Injection汉语拼音:ZhusheyongSanlinsuanbaogan erna本品主要成分及其化学名称为:三磷酸胞苷二钠。胞嘧啶核苷-5-三磷酸酯二钠。其结构式为:
分子式:C9H14N3Na2O14P3分子量:527.14【性状】本品为白色冻干块状物或粉末。【药理毒理】三磷酸胞苷二钠为辅酶类药,是核苷酸衍生物,在机体内参与磷脂类及核酸的合成和代谢,是脑磷脂合成与核酸代谢的中间产物和能量来源。【药代动力学】尚不明确。【适应症】用于颅脑外伤后综合症及其后遗症的辅助治疗。【用法用量】肌内注射,一次20mg,一日1~2次(20~40mg);静脉滴注,20mg加入5%葡萄糖注射液或生理盐水250ml中,或者40mg加入5%葡萄糖注射液或生理盐水500ml中缓慢静脉滴注。【不良反应】偶有发热、皮疹,停药后症状消失。极少数病人出现一过性轻度谷丙转氨酶升高,停药后恢复正常。本药对窦房结有明显抑制作用。【禁忌症】病窦综合征、窦房结功能不全者禁用,缓慢性心律失常者禁用。对本品过敏者禁用。【注意事项】1、严禁静脉推注。2、静脉滴注时,滴速不可过快,否则会引起兴奋、呼吸加快、头晕、头胀、胸闷及低血压等。3、严重肝、肾功能不全者慎用。癫痫患者慎用。4、心肌梗死、脑出血急性期慎用。5、当药品性状发生改变时禁止使用。【孕妇及哺乳期妇女用药】孕妇禁用,哺乳期妇女慎用。【儿童用药】尚不明确。【老年患者用药】老年人肝肾功能下降,应慎用,剂量遵医嘱。【药物相互作用】尚不明确。【规格】(1)20mg;(2)40mg 。【贮藏】密封,在阴凉干燥处保存。【包装】【有效期 】18个月。【批准文号】【生产企业】企业名称: 地址:邮政编码:电话号码:传真号码:网址:
【药品名称】通用名:三磷酸胞苷二钠注射液英文名:Cytidine Disodium Triphosphate Injection汉语拼音:Sanlinsuanbaogan erna Zhusheye本品主要成分及其化学名称为:三磷酸胞苷二钠。胞嘧啶核苷-5-三磷酸酯二钠。其结构式为:
【批准文号】【生产企业】企业名称:地址:邮政编码:电话号码:传真号码:网址:

 U633687664
U633687664
 U482683014
U482683014