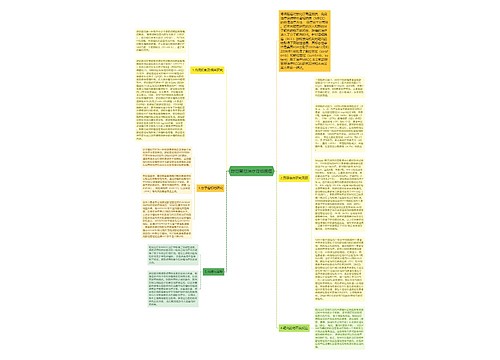
目前大多数研究认为青蒿素及其衍生物的抗肿瘤作用主要是通过诱导凋亡,但其促凋亡机制尚未完 全明了。双氢青蒿素对人乳腺癌MCF7细胞有很强的抑制作用,ICso为0.26 panol/L。流式细胞仪测定细胞周期发现,1 panol/L双氢 青蒿素作用24 h后,MCF7细胞被阻滞在G0+Gl期,s期细胞显著减少。说明双氢青蒿素抑制MCF7细胞增殖的机制之一是将细胞滞留在G0+Gl期 _l 。但亦有其他研究显示了不同结果。周晋等研究了青蒿素对人白血病细胞株NB4、K562和原代APL细胞的影响及可能机制,结果显示青蒿素对 NB4、K562和APL细胞的增殖明显抑制,其抗肿瘤机制有凋亡和胀亡两种,且细胞凋亡率随药物浓度增高而增加,随药物作用时间的延长而增加。流式细胞 仪测定结果显示青蒿素将细胞阻滞在G2+M期。作者认为白血病细胞膜是青蒿素作用的靶点 艺一,青蒿素可使白血病细胞内钙升高,致白血病细胞凋亡。青蒿素 同时通过开放某些细胞膜上的离: 通道,使细胞内钙浓度增加,激活caspase非依赖性细胞死亡形式,在没有三磷酸腺苷(ATP)缺乏时发生胀亡。董海 鹰等_研究青蒿素对体外培养的白血病K562细胞的凋亡诱导作用及机制,认为青蒿素对K562细胞明显的促凋亡机制可能与抑制内向整流钾电流有关,使线粒 体跨膜电位下降,导致促凋亡物质的释放激活,使细胞凋亡。分析以上研究可知,无论青蒿素类药物是使肿瘤细胞滞留在G0+G。期还是在G2+M期,亦无论其 促凋亡机制如何,诱导调亡是其发挥抗肿瘤作用的关键。
近年来,对青蒿素所致凋亡的分子机制也进行了探讨。王勤等在研究青蒿琥酯对肝癌细 胞的诱导凋亡机制时,发现青蒿琥酯下调增殖细胞核抗原(PCNA)和BCL一2基因的表达,上调BAX基因表达,而BCL一2和BAX基因参与调控诱导癌 细胞凋亡的P53非依赖性途径,故认为其凋亡的分子机制是P53非依赖性的。杨小平等的研究也证实了上述结论:肝癌细胞(BEL一7402)经青蒿琥酯处 理后可诱导人肝癌细胞(BEL一7402)凋亡,肝癌细胞中P53、P21蛋白表达水平无明显变化,而bc1—2蛋白表达水平降低.即与P53、P21无 关,而与凋亡调节基因bcl-2下调有关。
也有研究认为其抗肿瘤作用可能与抗疟机制相似,需Fe2 的参与。青蒿素类药物中的过氧基团 可通过与亚铁原子反应产生自由基或亲电子中间产物,而杀伤肿瘤细胞。美国华盛顿大学 曾提出如下假设:因为癌细胞需要铁才能在分裂时复制DNA,因此,癌 细胞含铁量比普通细胞高很多。如能大大提高癌细胞的含铁量,则癌细胞可被青蒿素选择性杀死。进一步研究发现添加转铁蛋白能提高双氢青蒿素对人乳腺癌细胞 ttTB27的杀伤能力,而对正常人乳腺细胞TB125没有明显的细胞毒作用。国内研究也发现外源添加FeC1 350~150μmol·L 可使双氢青 蒿素对人乳腺癌MCF7细胞的生长抑制率提高约30% ~50%。这种杀伤作用是否与铁离子参与青蒿素类药物的自由基产生过程,从而导致细胞坏死增多有 关,值得进一步研究。同时青蒿素具有选择性烷化蛋白质的作用,这可能与青蒿素结合了癌细胞内特殊的靶蛋白受体,从而导致肿瘤细胞死亡有关。这也可能是其抗 癌的重要机制之一。
综上所述,青蒿素类药物用于治疗疟疾已有上千年历史,在化学结构上有一定的新颖性,具有低毒、价廉等优点,尤其是其毒 副作用明显低于传统化疗药物,而近年来的体内外实验证实了青蒿素类药物显著的抗瘤活性。青蒿素类药物有可能成为具有临床应用价值的抗癌新药,但对其作用机 制和抗肿瘤活性作用仍需进行深入的研究
 U382061832
U382061832
 U182035684
U182035684