关于GSP认证工作的通知(2002)思维导图
一生孤注掷温柔
2023-02-21

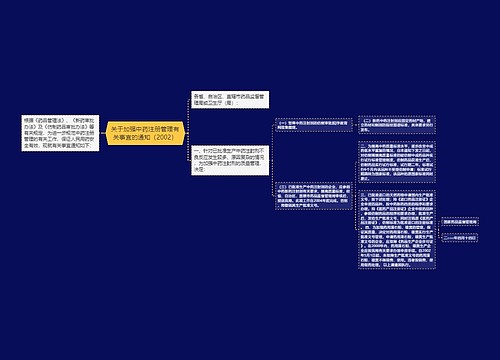
各省、自治区、直辖市药品监督管理局: 当前,《药品管理法》和《药品管理法实施条例》贯彻实施工作不断深入,《药品经营质量管理规范》(以下简称GSP)认证工作也已在全国范围内广泛开展起来,目前已形成良好的发展态势。按照我局制定的GSP认证实施步骤和药品监督管理工作要求,GSP认证工作必须进一步加快推进速度。
树图思维导图提供《关于GSP认证工作的通知(2002)》在线思维导图免费制作,点击“编辑”按钮,可对《关于GSP认证工作的通知(2002)》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:f2e2de563f6964681c09e3e82b9fc796