保健食品新功能产品申报与审评规定思维导图
心奴
2023-02-20
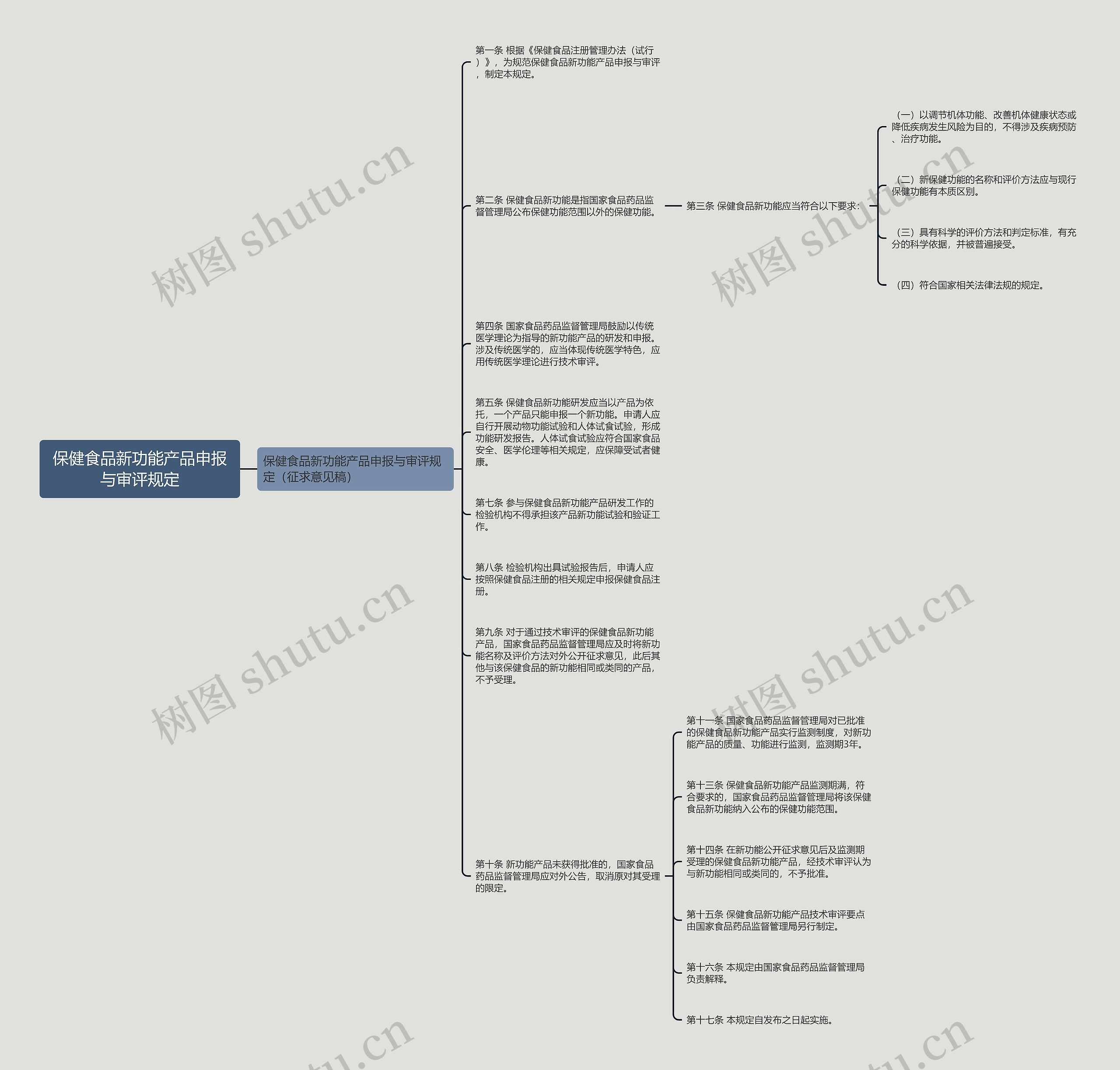
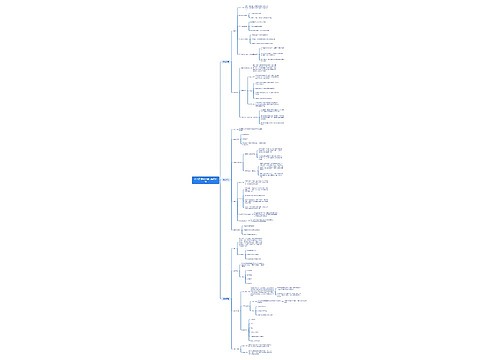
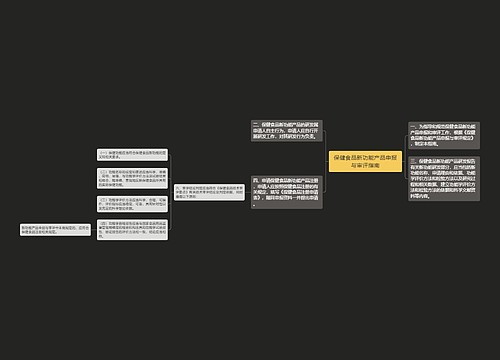
保健食品新功能产品申报与审评规定(征求意见稿) 第一条 根据《保健食品注册管理办法(试行)》,为规范保健食品新功能产品申报与审评,制定本规定。 第二条 保健食品新功能是指国家食品药品监督管理局公布保健功能范围以外的保健功能。
树图思维导图提供《保健食品新功能产品申报与审评规定》在线思维导图免费制作,点击“编辑”按钮,可对《保健食品新功能产品申报与审评规定》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:bb8f9daed52152229cb5a46bb1b46dd2
思维导图大纲
相关思维导图模版
9.战斗的基督教思维导图
 U582679646
U582679646树图思维导图提供《9.战斗的基督教》在线思维导图免费制作,点击“编辑”按钮,可对《9.战斗的基督教》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:33d168acd0cd9f767f809c7a5df86e3a
第六章 群体传播与组织传播_副本思维导图
 U882673919
U882673919树图思维导图提供《第六章 群体传播与组织传播_副本》在线思维导图免费制作,点击“编辑”按钮,可对《第六章 群体传播与组织传播_副本》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:1672f555831e7d9a3bb2cf2fb792cb49