恶性肿瘤的分子成像技术取得新进展思维导图
心不动则不痛
2023-02-17

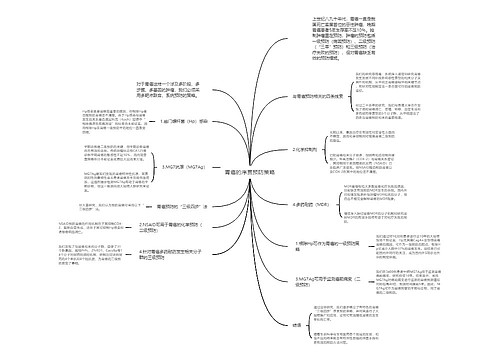
今后,当恶性肿瘤出现临床症状前,人们有望在分子水平就可以确定有无癌症的发生。最近,由哈尔滨医科大学附属第四医院博士生导师申宝忠教授完成的一项科技攻关项目《恶性肿瘤的分子成像》,在国内首次揭示了乳腺癌等肿瘤发生时细胞、亚细胞、基因分子水平上的改变和奥秘。
树图思维导图提供《恶性肿瘤的分子成像技术取得新进展》在线思维导图免费制作,点击“编辑”按钮,可对《恶性肿瘤的分子成像技术取得新进展》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:e0088eb0dd5505beca2ca0684356baf0
思维导图大纲
相关思维导图模版
904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查思维导图
 U633687664
U633687664树图思维导图提供《904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查》在线思维导图免费制作,点击“编辑”按钮,可对《904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:10b9a8a2dd2fb4593f8130ef16c320fc

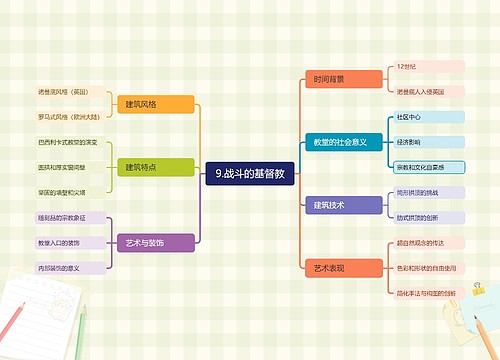
9.战斗的基督教思维导图
 U582679646
U582679646树图思维导图提供《9.战斗的基督教》在线思维导图免费制作,点击“编辑”按钮,可对《9.战斗的基督教》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:33d168acd0cd9f767f809c7a5df86e3a