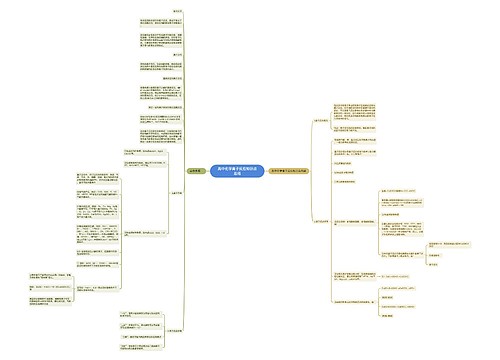
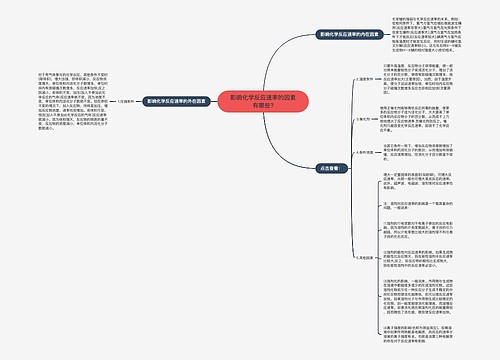
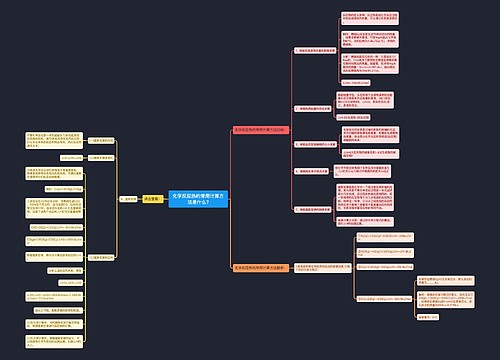
化学反应与能量变化知识点总结思维导图
心不动则不痛
2023-01-13

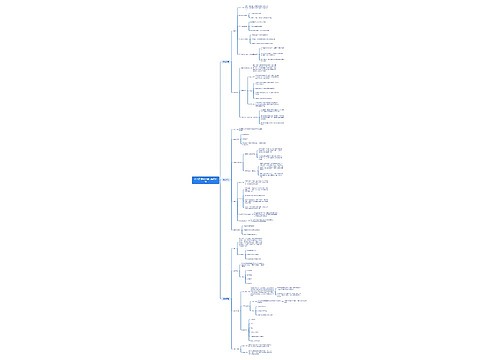
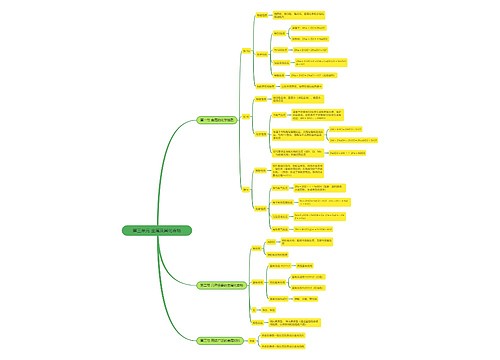
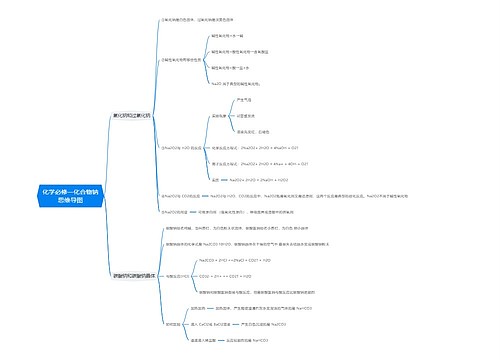
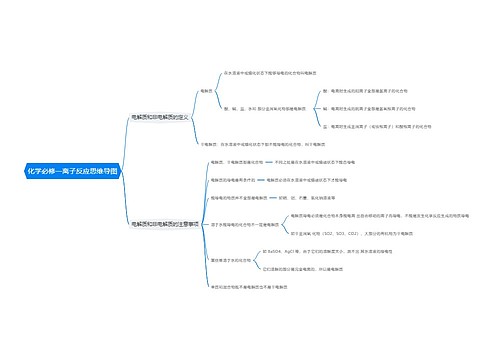
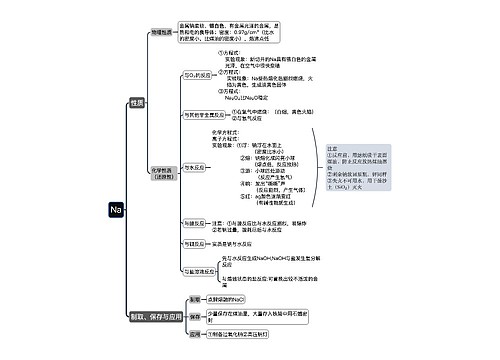
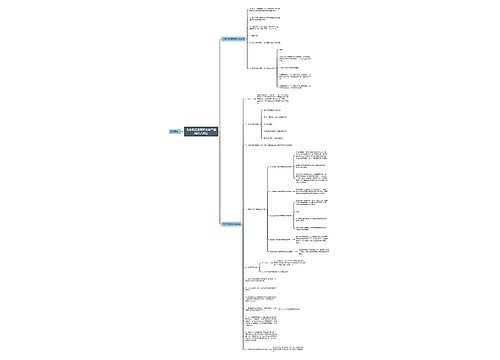
化学反应中的能量变化 化学反应中的能量变化,通常表现为热量的变化。下面是壹壹高考网小编整理的化学反应与能量变化知识点总结,供参考。
树图思维导图提供《化学反应与能量变化知识点总结》在线思维导图免费制作,点击“编辑”按钮,可对《化学反应与能量变化知识点总结》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:679f213ea5791e189fd34a32267f491f
思维导图大纲
相关思维导图模版
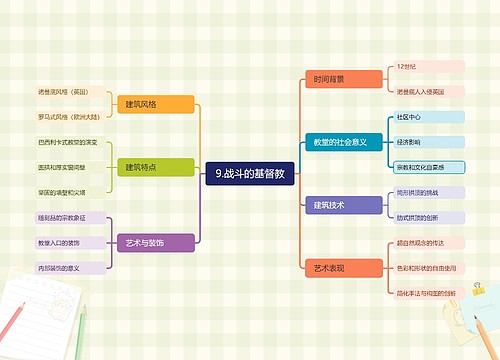
9.战斗的基督教思维导图
 U582679646
U582679646树图思维导图提供《9.战斗的基督教》在线思维导图免费制作,点击“编辑”按钮,可对《9.战斗的基督教》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:33d168acd0cd9f767f809c7a5df86e3a
第六章 群体传播与组织传播_副本思维导图
 U882673919
U882673919树图思维导图提供《第六章 群体传播与组织传播_副本》在线思维导图免费制作,点击“编辑”按钮,可对《第六章 群体传播与组织传播_副本》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:1672f555831e7d9a3bb2cf2fb792cb49