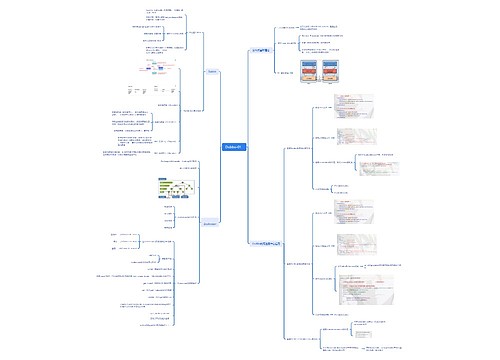
RNAi思维导图
U551973045
2023-11-30

在线虫中
究背景相当丰富
养线虫
显微注射法
RNAi介绍
树图思维导图提供《RNAi》在线思维导图免费制作,点击“编辑”按钮,可对《RNAi》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:10552b1a8abab43603a984cca0caba2a
思维导图大纲
相关思维导图模版
RNAi思维导图模板大纲
1.2.3 RNAi在线虫中的应用
线虫作为模式线虫,已成为许多试验青睐的研究对象。因为它生命周
期短,易于在体外生存,可以快速生产大量的虫体材料。此外,线虫的研
13 究背景相当丰富,
系统性分析基因的功能提供了坚实平台。除上述优势外,线虫还具备其他
特性特别适合RNAi实验研究。线虫RNAi实验比较简单,典型的RNAi实
验包括两步:用dsRNA处理两性成虫;检查其子代的表型特征。通过dsRNA
处理后,线虫比其他动物更能有效的发生RNAi作用。
目前,线虫dsRNA的导入方法有:显微注射dsRNA、在dsRNA中浸泡线
虫 (Timmons等 ,1998)、使用表达 dsRNA的细菌喂养线虫及稳定转化法
(Timmons,2001; Kamath,2000)。
1.2.3.1显微注射法
显微注射法是最初的RNA干扰试验采用的经典方法,通过直接注射
dsRNA到雌雄同体线虫的生殖器官,进入生殖器官后dsRNA很容易在干细
胞中扩散引起RNAi,这种效应可以传递到子代。Timmons等(1998)在
研究中发现RNAi具有扩散性,将双链RNA注射到线虫的某一部位后可以
在全身其它细胞中看到干涉现象。这种方法产生的表型外显率高,但不足
之处在于效率低,不适合用此法进行高通量筛选,同时干扰效果会随着细
胞分裂而不断降低,也不适合进行晚期表达基因研究,另外,注射法需要
体外合成dsRNA和手工注射操作,比较费时,很难用于对大量处理对象进
行多个基因的大规模功能分析。
1.2.3.2 浸泡法
浸泡法则是将线虫浸泡在dsRNA溶液中,然后分析线虫的表型变化。
该法可以同时对大量线虫材料进行处理,扩大了实验规模。但因为浸泡法
需要体外合成大量的dsRNA,所以缺点是费钱,而且干扰成功率不高。2005
年,Rosso通过浸泡的方法使根结线虫摄入含有其唾液腺基因的dsRNA,
发现能有效引发根结线虫相应基因的基因沉默。
1.2.3.3 饲喂法
饲喂法是给线虫饲喂表达dsRNA的大肠杆菌,从而产生RNA干扰效
果,该方法成功率近似于微注射,可大批量培养,成本低,主要的缺点是
需要在细菌中表达dsRNA。不过目前已有86%的线虫基因有现成的菌株可
用,而且菌株可以反复使用无数次,极大的降低了研究成本。
1.2.3.4 稳定转化法
14 稳定转化法是建立在转基因技术之上,将函折叠重复靶序列的质粒转
入线虫,从而体内转录生成发夹型RNA分子进入RNAi途径。研究发现,
对于生活史晚期和神经组织相关基因的RNAi研究,这种方法比前三种方
法更能有效地检测到线虫的表型变化。Huang Guozhong等人(2005)证明,
用dsRNA喂食线虫,能引起线虫相关基因的沉默,并且将dsRNA注射到拟
南芥上,拟南芥产生明显的RNAi抗虫作用。
1.3 抗根结线虫的育种进展
1.3.1 根结线虫的危害
根结线虫病害是严重制约世界农作物产量的重要病源线虫。根结线虫
包括90余种,寄主范围较广,受害严重的有葫芦科、茄科、花生等多种植
物(张芸,2005),传播途径多,是植物一种极难防治的土传性病害。病
害发生后,一般每年引起产量损失达10%~15%,严重时损失达30%~
40%,甚至绝产(赵鸿,2005)。引起蔬菜根结线虫病的主要有四种,即
南方根结线虫、北方根结线虫、爪哇根结线虫和花生根结线虫。
根结线虫的二龄幼虫侵入植物根部后,进入维管束向上移动,通过诱
导植物细胞分裂,形成巨大的、具有多细胞核的细胞:巨型细胞(GC,Giant
cell),并在此建立永久的取食据点(NFS,nematode feeding site)。根结线
虫通过从巨型细胞汲取营养和水分,生长发育为成虫。这个过程不但与植
株竞争养分,而且根结阻碍植物水分及营养的运输,严重危害植物生长。
同时,根结线虫的侵染为其它微生物的侵入创造了条件.
随着保护地栽培技术的推广,复种指数增加使得蔬菜根结线虫病根结
线虫病的的发生危害逐年加重,根结线虫的发生使蔬菜产量大幅度降低,
给农民造成严重损失,目前根结线虫的防治方法主要有化学防治、农业防
治和生物防治等方法,但这几种方式都存在一定的缺陷,从而限制了它们
的广泛使用。化学药剂毒性强,残留高,对环境污染大,不仅增加了成本,
对人类健康也不利,目前一大批线虫杀线剂被禁用;由于物种的引进或改
变对某一地区带来的生态影响是复杂和难以预料的,且生物本身往往存在
着一定地域性和寄生特异性,因此生物试剂不宜大面积推广;由于线虫在
土壤中寄生的时间可以长达十多年,使得作物轮作往往不能奏效或者只对
有限地域有限作物起有限作用;推广抗线虫品种是一种有效的防治线虫的
15 16
策略,但抗线虫种质往往是携带产量低等不利性状的野生资源,将抗源转
育到有潜力的优良材料中,培育成优良的抗病品种,不仅延长了选育周期,
而且一旦优势小种发生变异或劣势小种变为优势小种,立即会使得长期选
育的品种无法被利用,病原菌一旦侵染,其扩散的速度往往比选育的速度
快的多(Herrera-Estrella等,1999;翟文学等,1996)。
1.3.2 抗根结线虫策略的分子研究
近年来,随着对线虫侵染的方式、植物自身抗病防御体系研究的不断
深入,以及分子生物学理论和生物工程技术的不断发展,人们开始利用从
分子水平来研究线虫并进行了抗线虫的分子育种。
根结线虫的生活史包括线虫的侵入、取食和繁殖等几个阶段,而每个
阶段的被破坏都可以达到抗线虫的目的。一种方法是利用植物抗体或抗体
片断来结合并封闭线虫的分泌物达到抗线虫的目的;还可以利用植物蛋白
酶抑制剂干扰线虫的取食和消化;另外还可以阻止根结线虫诱导巨细胞的
形成,从而破坏其结构或在巨细胞中表达线虫毒性基因达到抗线虫的目的
(魏振林等,2007)。
1.3.3 蔬菜抗根结线虫研究进展
危害黄瓜的根结线虫主要是南方根结线虫、北方根结线虫、爪哇根结
线虫和花生根结线虫四种,而栽培黄瓜品种都抗北方根结线虫,而不抗南
方根结线虫、爪哇根结线虫和花生根结线虫,因此育种者们试图将黄瓜属
野生种的抗线虫基因转入栽培种中,但由于种间的染色体数目不同(除黄
瓜n=7外,其他种的染色体数目多为n=12),利用传统的杂交方法十分困难,
而且抗线虫基因大多来自野生或半野生种属,而且常与不良的农艺性状连
锁,因而黄瓜的抗线虫育种上较其他作物进展缓慢。目前为止国外测试的
数百份黄瓜材料均未发现四种根结线虫都抗的(Winstead,1956;Walters,
1993),Walters 和Wehner(1996)育成的几个抗线虫的黄瓜品种不是商
品性不好,就是只能作为加工品种,且都不抗南方根结线虫。国内,顾兴
芳等人(2006)将108份黄瓜嫁接砧木进行抗南方根结线虫能力鉴定,结
果发现,以野生瓜棘瓜为砧木的黄瓜嫁接苗抗南方根结线虫能力强。
在番茄中,存在抗根结线虫基因Mi基因,Mi基因显性基因控制着番
茄对南方根结线虫的抗性,Mi基因是所有番茄栽培种的唯一抗源,许多野生番茄中均含有该基因,这种抗性基因具有广谱抗性,能有效地抗几种
根结线虫。目前已从番茄中一共发现9个抗根结线虫的基因Mi-1, Mi-2,
Mi-3,Mi- 4,Mi-5,Mi-6,Mi-7,Mi-8,Mi-9。Mi-1被定位在番茄的第6
染色体上,单个的显性位点Mi-3对南方根结线虫的毒性群体表现抗性,它
被定位在12染色体的远端,与热稳定性抗南方根结线虫基因Mi-5紧密连
锁。此外还发现Mi-2与Mi-8连锁、Mi-6与Mi-7连锁。Mi-2, Mi-4,Mi-5
和Mi-6基因耐高温, 在土壤温度达到32℃条件下,还维持对南方根结线
虫的抗性,而Mi-7和Mi-8在25℃条件下,对Mi基因有毒性的南方根结线
虫群体表现抗性,这些抗性基因为番茄抗根结线虫的育种提供了丰富的遗
传资源(彭德良,2001)。目前许多发达国家都相继从秘鲁番茄中引入
Mi基因,选育出抗根结线虫的栽培番茄。Am-mati,Cop分别利用胚培养
成功地将抗性基因转入杂种中,并获得抗性植株。Kaloshian等(1998)用
定位克隆的方法从野生番茄Lycoperisicon peruvianum中分离到Mi基因,然
后用DNA重组技术将Mi基因定位于番茄第6染色体上的一小段区域中,通
过对连续52KbDNA的序列分析,得出抗北方根结线虫外的其他3种根结线
虫的番茄栽培种。 Williamson等(1996)将野生番茄品种的抗根结线虫病
基因Mi转入普通番茄,转化的番茄植株能抗根结线虫病。我国目前也在
开展这方面的研究工作,据于秋菊等(1999)报道已经筛选出了一批抗番
茄根结线虫材料,其中对南方根结线虫免疫材料2个,高抗材料4个,强抗
材料4个,中抗材料2个,并正在加以利用。华中农业大学也选择出一批抗
番茄根结线虫材料(蔡福民, 2000),刘维信等(2000)报道筛选出3份
对番茄根结线虫免疫的材料。赵泓等(2004)运用胚珠培养法,以含Mi-3
基因的秘鲁番茄为父本,与栽培番茄杂交,获得了具有非温敏抗根结线虫
病基因Mi-3的种间杂种。
目前报道的关于辣椒根结线虫病的研究大多是国外研究。Martin
(1948)在1948年首次报道了辣椒品种对根结线虫的抗性,标志着辣椒抗
根结线虫育种的开始。在辣椒属中存在多个抗性基因,Hare于1957年首次
报道了辣椒对南方根结线虫的抗性是由单显性基因控制的,并将他发现的
第1个抗根结线虫的基因命名为N,此基因抗南方根结线虫、爪哇根结线
虫和花生根结线虫,在28℃以上会丧失部分抗性。Hendy等(1985)通过
17 双单倍体群体,在PM217、PM687和Yolo W onder上共发现5个抗病显性基
因。1958年Martin选育出抗根结线虫的干椒品种。此后,人们通过各种育
种方式进行辣椒抗根结线虫育种,相继育成了一此抗病品种。1998年美国
农业研究局基因学家Fery利用回交转育方法培育出两个抗南方根结线虫
的辣椒新品种Charleston Bell和Carolina Wonder:它们具有抗性基因N,对
南方根结线虫具有较强的抗性(Fery,1998)。我国对辣椒抗根结线虫的
研究起步较晚,“十五”期间国家攻关项目才明确提出要选育抗根结线虫
的甜椒育种材料(张宝玺,2005),但目前并没有好的抗线虫的材料。
3.2 抗根结线虫基因的 RNA 干扰表达载体的构建
3.2.1 16D10 基因的克隆
为了获得根结线虫
线虫的黄瓜根系总 RNA,其电泳结果显示为四条带,如图 4。以此 RNA
为模板,用引物 16DTR,采用 RT-PCR 法,在感染线虫的黄瓜总 RNA 中
扩增出 300 bp 左右与预期片段大小一致的特异性条带(见图 5),然后回
收该片段。将该目的片段连接到与 pMD18-T 载体上,得到载体
pMD-16D10, PCR 鉴定证实获得的 300 bp 左右的条带,跟预期目的片段
大小一致(图 6),进一步用
段,也与预期目的片段大小一致(图 7)。
图4 总RNA提取
Fig 4 Total RNA of cucumber root
1:不带根结的黄瓜根RNA
2,3:带有根结的黄瓜根RNA
图5 16D10基因的RT-PCR结果
Fig 5 RT-PCR product for 16D10
M:Marker DL2000
1. 水
2. 健康黄瓜根总RNA RT-PCR扩增结果
3. 感染根结线虫黄瓜根总RNA RT-PCR扩
增结果
图6 pMD18-16D10的PCR鉴定
Fig6:Identification of plasmid PCR(a) for
pMD18-16D10
M:MarkerDL2000;
1:pMD18-16D10的PCR结果;
2:ddH2O;
图7 pMD18-16D10的酶切鉴定
Fig 7:Restriction analysis for pMD18-16D10
M:MarkerDL2000;
1-3:pMD18-16D10/
经上海生物工程公司进行测序,测序结果与已经公布的南方根结线虫
的序列只有两个碱基的不同,同源性达 99%以上(图 8)。
43 44
图8 16D基因的同源性分析
Fig.8 Homology analysis of 16D with southward nematode
Upper line: article incognita.seq, from 1 to 337
Lower line: pMD-16D, from 1 to 336
article incognita.seq:yu identity= 99.70%(335/336) gap=0.30%(1/337)
1 GAGAAAATAAAATATAAATTATTCCTCAAAAATACCATAAAGTTAATTATTCTTCAATCA
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
1 GAGAAAATAAAATATAAATTATTCCTCAAAAATACCATAAAGTTAATTATTCTTCAATC.
61 AAAAAATGTTTACTAATTCAATTAAAAATTTAATTATTTATTTAATGCCTTTAATGGTTA
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
60 AAAAAATGTTTACTAATTCAATTAAAAATTTAATTATTTATTTAATGCCTTTAATGGTTA
121 CTTTAATGCTTTTGTCTGTCTCATTTGTGGATGCAGGCAAAAAGCCTAGTGGGCCAAATC
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
120 CTTTAATGCTTTTGTCTGTCTCATTTGTGGATGCAGGCAAAAAGCCTAGTGGGCCAAATC
181 CTGGAGGAAATAATTGAAGAAAAATGATTGAAGAAAAACGTTTAAATTAAACGATAAATG
||||||||||||||||||||||||||||||||||||||||||||||||||| ||||||||
180 CTGGAGGAAATAATTGAAGAAAAATGATTGAAGAAAAACGTTTAAATTAAATGATAAATG
241 GGAAATAATGGAATTTAAATTAAGCTAATTTTGATGGTTTCCTTTGTTAATTTCAACATA
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
240 GGAAATAATGGAATTTAAATTAAGCTAATTTTGATGGTTTCCTTTGTTAATTTCAACATA
301 AAATTAATTGAATTTACTGAATAAAATTATATCTGAAAAAAAAAAAAAAAAAAAAAAAAA
|||||||||||||||||||||||||||||||||||||
300 AAATTAATTGAATTTACTGAATAAAATTATATCTGAA
载体 pBLUE-22 的构建:以含 16D10 基因的 T 载体为模板,然后用
引物对 16D10i-22-F 和 16D10i-22-R 扩增反义基因片段,结果表明,所得
到的扩增条带均为单一条带,其大小为 270 bp 左右,与预期的目的片段
的大小基本一致。将反向 PCR 产物用
样用这两种酶进行酶切后的 pBLUE-Nir 载体上,命名为 pBLUE-22, 然
后对 pBLUE-22 质粒用
左右的片段,与预期大小一致,表明已经成功将反义片段连入 pBLUE-Nir
载体上(图 9)。
图9 pBLUE-22的酶切鉴定
Fig 9: Restriction analysis for pBLUE-22
M:MarkerDL2000;
1:pBLUE-22/
载体 pBLUE-22-21 的构建:采用同样的技术策略,再将正向 PCR 产
物用
命名为 pBLUE-22-21,用
的片段,酶切后电泳检测得到了 800 bp 的片段,与预期大小一致,而
pBLUE-22 酶切后是 500bp 的带,表明已将 16D10 基因正向连入 pBLUE-22
载体中(见图 10)。
45 46
3.2.3 中间克隆载体的构建
将 pBLUE-22-21 用
上述两种酶酶切的 pRTL2 连接,命名为 pRTL2-22-21。用
应得到2000 bp的带,电泳结果表明所获得的条带与理论值相符(见图11),
表明目的片段已连入 pRTL2 中。
3.2.4 植物表达载体的构建
将 pRTL2-22-21 用
进行酶切的 pBIN19 载体连接。用
的带,电泳结果表明所获条带的大小与理论值相符,表明目的片段已连入
图10 pBLUE-22-21载体的酶切鉴定
Fig 10: Restriction analysis for pBLUE-22-21
M. λDNA/
1. pBLUE-22-21/
/
(约0.8kb)
2. pBLUE-22/
/
(约0.5kb)
M:.λDNA/
1: pRTL2/HindⅢ(约1.2kb)
2: pRTL2-22-21/HindⅢ (约2.0kb)
图11 pRTL2-22-21载体的酶切鉴定
Fig 11:Restriction analysis for pRTL2-22-2147
植物表达载体 pBIN19 中(见图 12)
5.2 抗根结线虫的 RNAi 表达载体构建
构建了能形成双链的 pBLUE-22-21 载体,并将此双链基因插入到由
35S 启动子调控的克隆载体 pRTL2 上,命名为 pRTL2-22-21,再将含有启
动子和终止子以及双链的目的片段插入到双元表达载体 pBIN-19 上,得到
表达载体 pBIN-22-21。
查看更多
相似思维导图模版
首页
我的文件
我的团队
个人中心