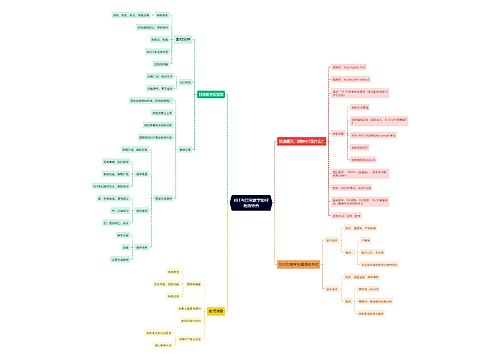
PM需要在临床试验活动开始前,确保以下文件完成起草或协调其它部门进行制定项目管理计划,包括:监查计划,对监查类型、频率、时间、内容等进行规定,此文件接触比较多,不在赘述。
培训计划,主要针对项目团队和研究者的培训阶段、内容、培训者和被培训人员、培训方式以及培训记录进行计划和制定。例如在培训计划中会规定在项目执行阶段,培训内容:EDC 常见query及解决办法,培训人是DM或PM,培训频率是月度还是按需?培训形式是实时线上/还是录屏?参加者是CRA还是CRC。
沟通计划,确定项目团队的沟通形式和频率,报告和问题升级流程,确保项目成员的有效沟通。例如最常见的项目例会,沟通形式是线上,沟通对象是所有CRA,沟通频次是1次/1周or2周?时间是每周五下午2-3点,发起人是PM,记录者是CTA还是APM,沟通结果发送至谁?等等。
风险管理计划,对项目开展过程中的可能产生风险类别、原因、概率、CAPA等进行计划,如风险:受试者入组困难,原因是竞争项目/病源/方案设计等等,CAPA是修改方案、投入资源如招募团队等等。
质量管理计划,主要规定项目的执行质量标准和计划是什么,如使用的SOP有哪些、CRM和PM的协同监查计划、QC/QA计划、eTMF审阅计划等等。
方案违背管理计划,由于变更比较频繁,所以一般从质量管理计划中脱离出来单独起草,主要内容是拟定PD list,分级,上报流程是怎样的。
药品管理计划,主要对试验药/阳性药预估总量/每月用药等进行计划。
除此之外,还涉及到其他部门的:统计分析计划、医学监查计划、数据管理计划、数据核查计划、安全性管理计划等等,在此不再详细介绍。
项目层面的文件,在规划和启动阶段,主要是和医学/PV部门一起尽快起草/审核/定稿方案、研究者手册、知情同意书以及如问卷、日记卡、招募广告等其它文件。
项目层面的SOP,项目中经常需要用到,不仅仅是operation相关的PSV-SSU-SIV-SMV-COV全流程的SOP,还有涉及MM、DM、SA、PV等相关的SOP需一起汇总整理(选择性做,主要一方面考虑部分外资SOP体系庞杂,更新频繁,一方面是部分内资SOP体系不完善及CRA流动性大,CTA和APM整理可方便CRA及项目团队查阅,尽快融入项目)
项目层面的表格,PM需要根据公司SOP及项目特定需求,负责起草和制定项目层面的表格:如SIV相关的确认信+随访信、日程、签到表、授权表、培训表、会议纪要、ISF目录、源数据鉴定表格等;药物相关的,如药品发放接收/库存分/转运/配置输液/生命体征/偏离报告/回收销毁/温度记录表等;受试者相关的,如入组审核/筛选/签认代码/肿瘤评估表等;样本相关的,如样本采集/离心/储存温度/库存/寄送表等;安全性相关的SAE及妊娠报告表;物资相关的发放/接收/回收/销毁表;以及其他供应商系统涉及表格也可以归到此处。
项目层面的模板,如病历书写、递交信、说明、CRA相关工具表、一些计算公式表等,也需要PM负责提前制定。

 U882667602
U882667602
 U182637395
U182637395