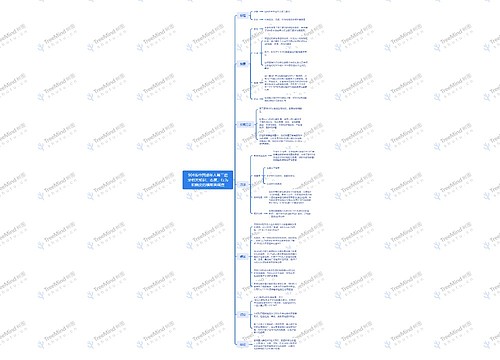
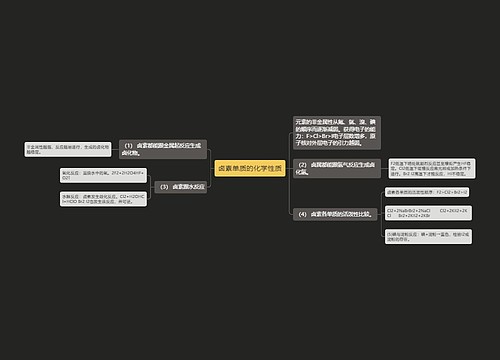
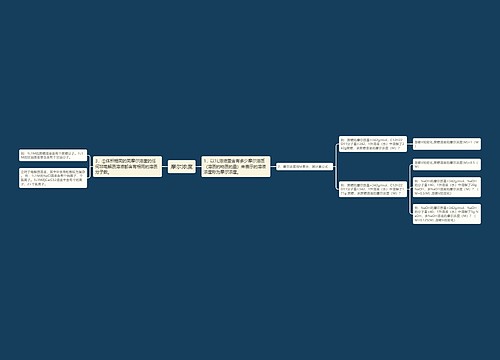
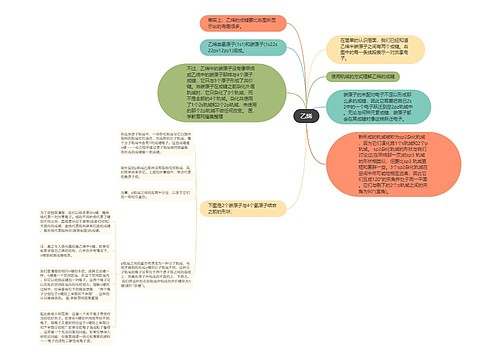
甲烷(CH4)思维导图
花房姑娘
2023-02-22

虽然你已经对甲烷的点-线成键示意图(右图)很熟悉了,但我们仍然需要进一步的研究甲烷的成键。 示意图中的甲烷分子结构与碳的电子排布(1s22s22px12py1) 之间存在着严重的冲突。根据碳的近代电子排布,其外层可以跟氢原子共享的电子(未配对电子)只有2个,而示意图中的碳原子提供了4个电子与氢原子共享。
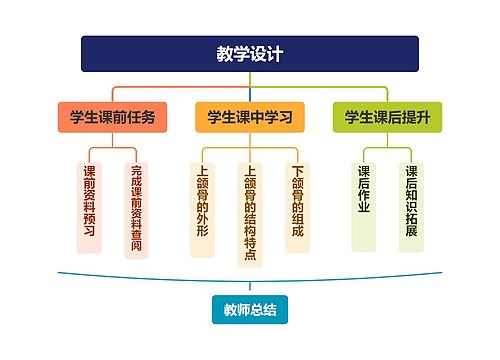
树图思维导图提供《甲烷(CH4)》在线思维导图免费制作,点击“编辑”按钮,可对《甲烷(CH4)》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:f07ea63cb3dad61d87836e30055e34d5
思维导图大纲
相关思维导图模版
高二化学备考:高二化学有机物起始课和甲烷1思维导图
 不爱计较
不爱计较树图思维导图提供《高二化学备考:高二化学有机物起始课和甲烷1》在线思维导图免费制作,点击“编辑”按钮,可对《高二化学备考:高二化学有机物起始课和甲烷1》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:b299d271f73491ba5b9fbdc0c0f51f55

高二化学备考:高二化学有机物起始课和甲烷2思维导图
 没顾忌
没顾忌树图思维导图提供《高二化学备考:高二化学有机物起始课和甲烷2》在线思维导图免费制作,点击“编辑”按钮,可对《高二化学备考:高二化学有机物起始课和甲烷2》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:86e6671a2ec8278a2edb28c3feb389c6