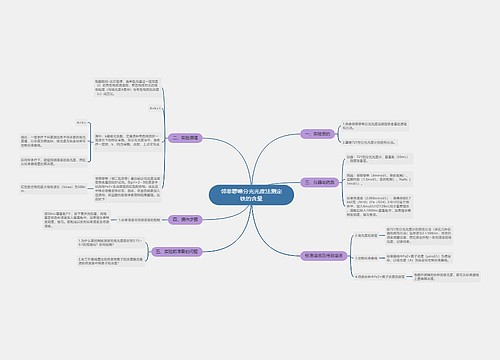
铁、钴、镍及其化合物思维导图
情书
2023-02-21

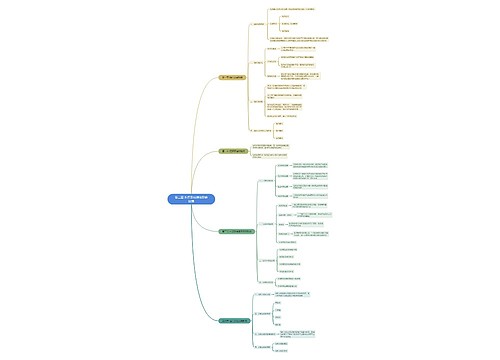
一、实验目的 1.试验并掌握铁、钴、镍氢氧化物的生成和氧化还原稳定性。 2.试验并掌握铁、钴、镍的配位化合物的生成。 3.掌握Fe3+、Co2+、Ni2+的鉴定反应。 二、实验提要 铁、钴、镍是周期系第Ⅷ族元素第一个三元素组,它们的原子最外层电子数都是2个,次外层电子尚未满足,因此显示可变的化合物价,它们的性质彼此相似。
树图思维导图提供《铁、钴、镍及其化合物》在线思维导图免费制作,点击“编辑”按钮,可对《铁、钴、镍及其化合物》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:f9380b72bfc7ed19aaeb02184109d220
思维导图大纲
相关思维导图模版
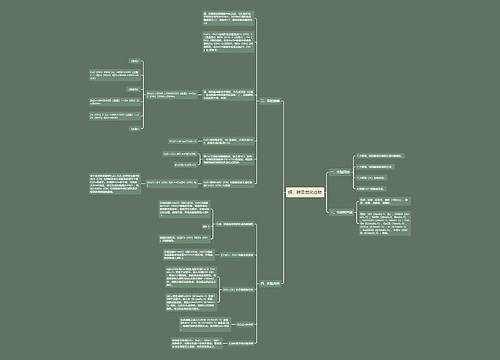
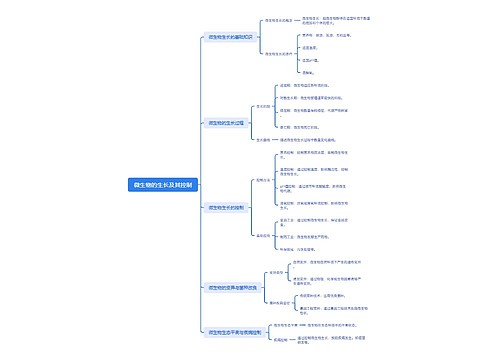
微生物的生长及其控制思维导图
 U881803229
U881803229树图思维导图提供《微生物的生长及其控制》在线思维导图免费制作,点击“编辑”按钮,可对《微生物的生长及其控制》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:e3f7508625536c9f8227e5d0a05aa35f
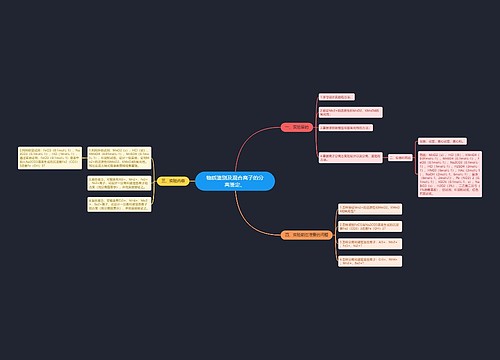
第二章 组织及其绩效影响因素思维导图
 U381347999
U381347999树图思维导图提供《第二章 组织及其绩效影响因素》在线思维导图免费制作,点击“编辑”按钮,可对《第二章 组织及其绩效影响因素》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:1919a947f88bc2d8550efe05fd639dac