铜、锌及其化合物思维导图
西风不相识
2023-02-21

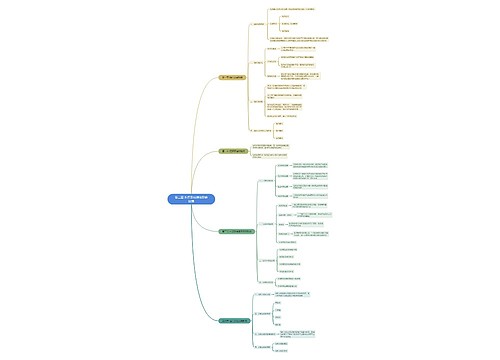
一、实验目的 1.了解铜、锌的氢氧化物的生成和酸碱性; 2.了解铜、锌的氨配合物的生成; 3.了解铜(Ⅱ)的氧化性; 4.掌握Cu2+的鉴定方法。
树图思维导图提供《铜、锌及其化合物》在线思维导图免费制作,点击“编辑”按钮,可对《铜、锌及其化合物》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:550d547cd61cc6cc5ba8eb3f3a4de678
思维导图大纲
相关思维导图模版
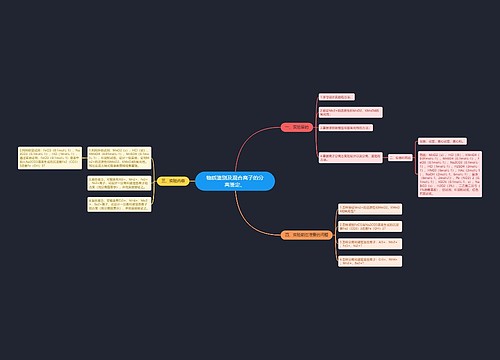
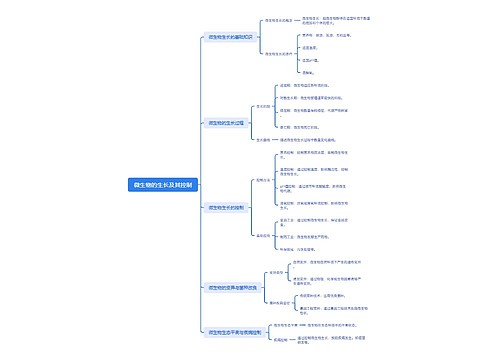
微生物的生长及其控制思维导图
 U881803229
U881803229树图思维导图提供《微生物的生长及其控制》在线思维导图免费制作,点击“编辑”按钮,可对《微生物的生长及其控制》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:e3f7508625536c9f8227e5d0a05aa35f
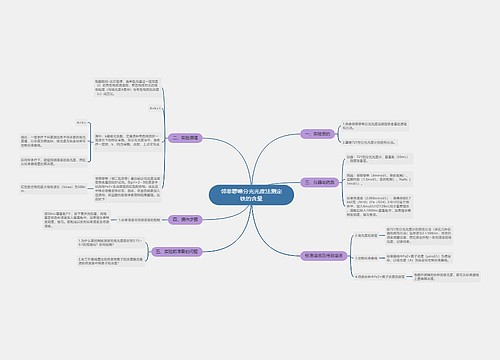
第二章 组织及其绩效影响因素思维导图
 U381347999
U381347999树图思维导图提供《第二章 组织及其绩效影响因素》在线思维导图免费制作,点击“编辑”按钮,可对《第二章 组织及其绩效影响因素》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:1919a947f88bc2d8550efe05fd639dac