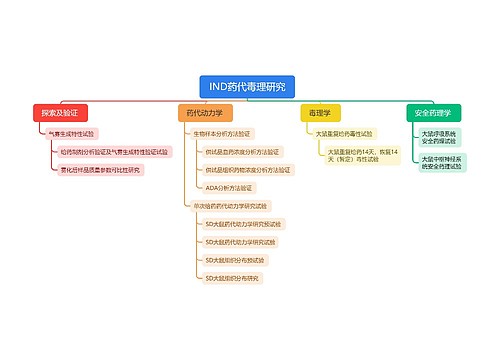
第十二条 用于药品制剂注册和已批准上市药品制剂的药用原辅材料的厂商,应当通过药用原辅材料备案信息平台提交原辅材料的信息。
用于已批准上市药品制剂的原辅材料,可以在规定的时间内进行备案,备案时应提供使用该原辅材料的制剂情况。
首次用于药品制剂的原辅材料,可以在与其相链接的制剂注册申请提交后20日内进行备案。
第十三条 原辅材料厂商提交的原辅材料备案信息应当包括生产过程中使用的起始物料、中间产物、生产工艺、质量指标、检验方法等内容。
第十四条 药用原辅材料备案完成后,备案信息平台自动赋予备案号医`学教育网搜集整理。
第十五条 药用原辅材料厂商应当对起始物料、中间产物和生产过程等进行质量控制,对外购的起始物料和中间产物,应当对供应商资质和生产质量保证体系等进行审计,形成审计报告并作为备案信息一并提交。
第十六条 药用原辅材料生产发生变更时,原辅材料厂商应当进行相应的研究,评估其变更对该原辅材料质量的影响,及时变更备案信息,包括变更研究资料和评估报告,同时通知使用该原辅材料的药品制剂厂商。
第十七条 当药用原辅材料备案信息发生变更时,备案信息将作相应的变更,同时备案号加注变更的标记。
第十八条 药品制剂厂商应当及时了解制剂所使用的原辅材料的变更情况,对原辅材料变更带来的影响进行研究和评估,并根据相关规定进行制剂的变更申报。同时应当对变更后的原辅材料进行审计。