国外医药监管:法国健全监管体制阻挡假药上市思维导图
眼眶很热
2023-02-21

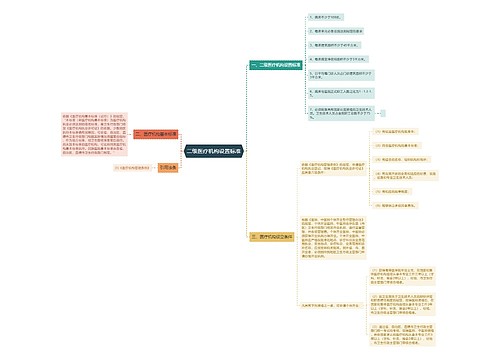
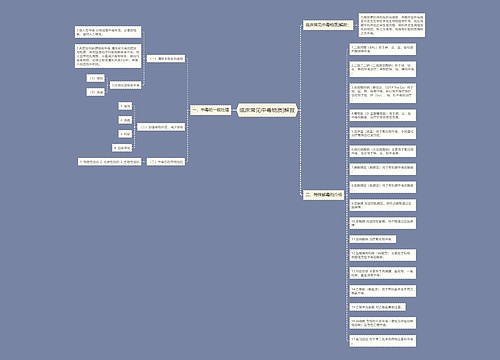
法国百姓在药店买药通常无须担心买到假药,这主要是因为国家建立了一套健全的医药监管体制。法国政府设有专门的药品监管机构,不但有效阻挡假药上市,而且及时让质量和疗效不佳的药品退市。
树图思维导图提供《国外医药监管:法国健全监管体制阻挡假药上市》在线思维导图免费制作,点击“编辑”按钮,可对《国外医药监管:法国健全监管体制阻挡假药上市》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:a5cda329ade61dc8e7f08de0def30c9a
思维导图大纲
相关思维导图模版
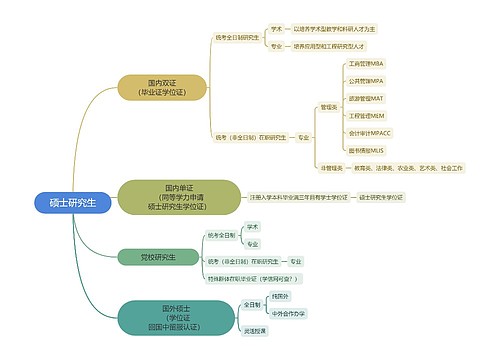
硕士研究生思维导图
 天天向上
天天向上树图思维导图提供《硕士研究生》在线思维导图免费制作,点击“编辑”按钮,可对《硕士研究生》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:8528b76142aa72db1ab54df9efe11639
在党的二十届三中全会第二次全体会议上的讲话思维导图
 U230224119
U230224119树图思维导图提供《在党的二十届三中全会第二次全体会议上的讲话》在线思维导图免费制作,点击“编辑”按钮,可对《在党的二十届三中全会第二次全体会议上的讲话》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:3f87b3e9597430e443dcb980efa0ea2d