医疗器械的管理方法|手段思维导图
青烟
2023-02-20

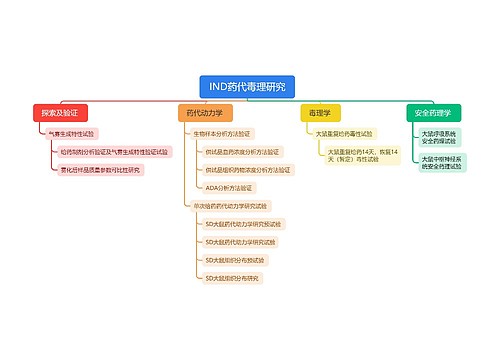
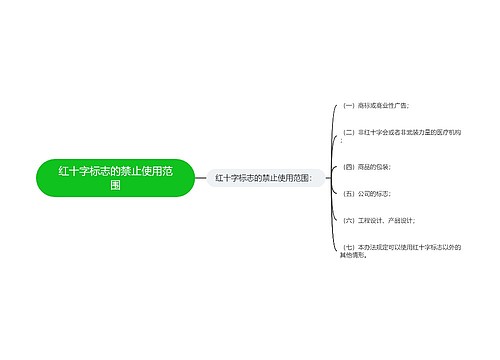
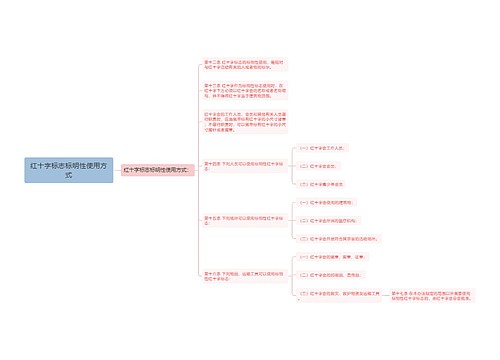
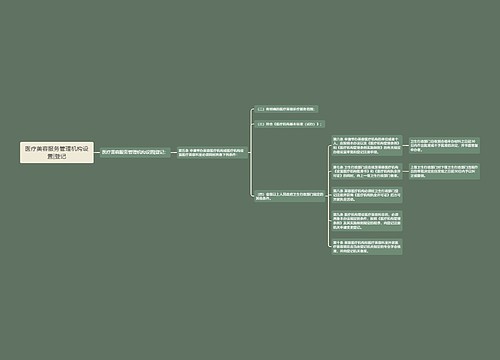
医疗器械的管理方法|手段: 第七条 国家鼓励研制医疗器械新产品。医疗器械新产品,是指国内市场尚未出现过的或者安全性、有效性及产品机理未得到国内认可的全新的品种。 第二类、第三类医疗器械新产品的临床试用,应当按照国务院药品监督管理部门的规定,经批准后进行。
树图思维导图提供《医疗器械的管理方法|手段》在线思维导图免费制作,点击“编辑”按钮,可对《医疗器械的管理方法|手段》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:2c8493d0f6d537fab78e4cb9115767b1
思维导图大纲
相关思维导图模版
904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查思维导图
 U633687664
U633687664树图思维导图提供《904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查》在线思维导图免费制作,点击“编辑”按钮,可对《904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:10b9a8a2dd2fb4593f8130ef16c320fc
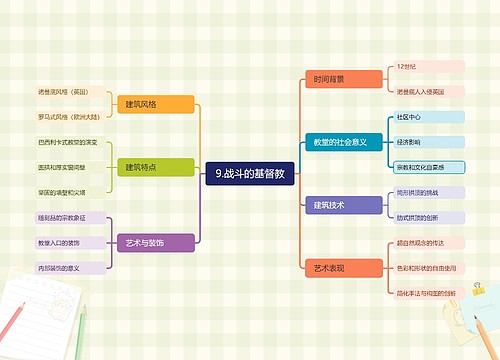
9.战斗的基督教思维导图
 U582679646
U582679646树图思维导图提供《9.战斗的基督教》在线思维导图免费制作,点击“编辑”按钮,可对《9.战斗的基督教》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:33d168acd0cd9f767f809c7a5df86e3a