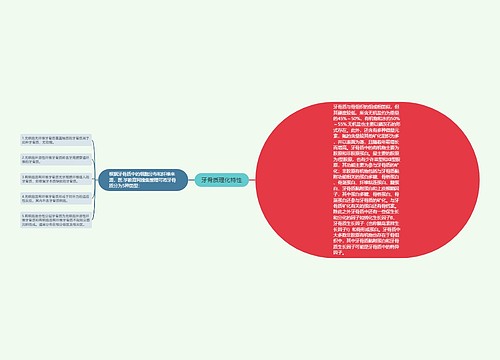
近期来自中南大学湘雅医学院肿瘤研究所,教育部癌变与侵袭原理重点实验室的研究人员介绍了低氧诱导因子1, c-Myc, p53等转录因子与肿瘤糖代谢的相互调节作用,指出这种关联为靶向代谢的抗癌药物的研究提供了新思路。相关研究成果公布在《科学通报》上。能量代谢重编程是肿瘤的重要特征之一, 快速增殖的肿瘤细胞以高速率的糖酵解为主要的供能方式, 促进肿瘤对缺氧等应激环境的适应, 增加肿瘤的恶性潜能。其中转录因子对糖代谢基因的调控是肿瘤能量代谢重编程的重要机制之一,
文章的通讯作者是中南大学肿瘤研究所曹亚教授,曹亚教授早年毕业于湖南医科大学(湘雅医学院前身),主要研究方向为肿瘤发病分子机理研究,迄今发表学术论文100余篇。2011年曾与国外学者共同在Nature Reviews Cancer杂志上发表文章,围绕癌症研究的发展展开了论述。
能量代谢重编程对肿瘤的发生发展具有重要意义,20世纪初Warburg就提出快速增殖的肿瘤细胞以“有氧糖酵解”为主要产能方式, 目前这一观点已在不同类型的肿瘤中得到证实, 并成为肿瘤糖代谢研究的基础医|学教育网搜集整理。
癌基因的激活、抑癌基因的失活等使肿瘤细胞对代谢的调控具有自主性,以此导致的I3K/Akt 信号通路的异常活化是肿瘤糖代谢改变的主要机制。PI3K/Akt 信号通路下游的转录因子调控糖代谢的多个进程。其中低氧诱导因子-1 (hypoxia nducible factor-1, HIF-1)和 c-Myc 是主要的促进糖酵解的转录因子, p53 是最具代表性的抑制糖酵解、维持线粒体功能的转录因子,核因子 κB (nuclear actor-κB, NF-κB), FOXO3A, 信号转导与转录激活因子 3 (signal transducers and activators of transcrip-on 3, STAT 3)等在肿瘤糖代谢中的作用也日益明确。
其中关于著名的抑癌基因p53,研究人员指出近年发现, Parkin能作为p53的下游基因与p53协同调节糖代谢并在抵抗氧化应激中发挥作用,p53 也可以直接抑制GLUT1 和 GLUT4 的表达, 并通过 NK-κB 信号通路间接抑制 GLUT3. TIGAR 在 p53 调控下催化 2,6-二磷酸果糖(2,6-BFP)的降解, 使磷酸果糖激酶-1 失去 2,6-BFP 的变构激活作用。
p53对线粒体功能的稳定作用主要表现在对酶的调节上:p53 对 SCO 细胞色素氧化酶缺陷同源物(SCO cytochrome oxidase difecient homolog 2, SCO2)的活化维持了氧化呼吸链的电子传递, 对核糖核酸还原酶亚基 p52R2 的诱导促进了线粒体DNA的稳定。
通常p53表现的是对细胞异常增殖的抑制作用, 但是另一方面, p53 也可以通过代谢调节促进特定环境中细胞的生存。例如, 当抑制氧化磷酸化药物作用于细胞时, p53 能促进糖酵解以增强细胞对不利环境的耐受能力。这说明 p53 在细胞受到基因毒性损伤时, 可促进并借助能量代谢重编程发挥损伤修复的作用, 而当这些损伤无法逆转时, p53 将促进恶性的细胞凋亡医|学教育网搜集整理。
自“Warburg effect”提出以来, 学者们对肿瘤糖代谢的过程及特征已有了清楚的认识, 但对于其发生及调控机制的研究仍有待完善。 虽然 HIF, c-Myc, p53 在糖代谢中的功能已各自得到明确, 但是其他转录因子对代谢的调控还有待进一步探索, 而糖代谢对转录因子的调节更是一个值得研究的课题。的认识,但对于其发生及调控机制的研究仍有待完善。虽然HIF,c-Myc,p53在糖代谢中的功能已各自得到明确,但是其他转录因子对代谢的调控还有待进一步探索,而糖代谢对转录因子的调节更是一个值得研究的课题。

 U882673919
U882673919
 U982669071
U982669071