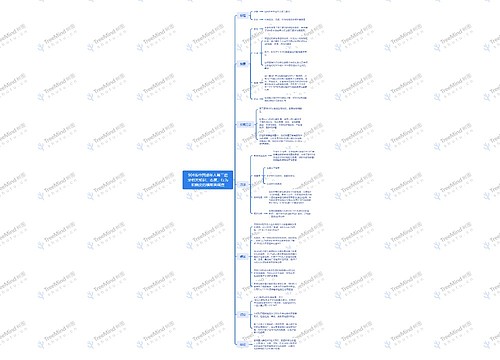
FDA发现喹诺酮类外周神经病变警告思维导图
失落感
2023-02-17

美国食品药品管理局(FDA)要求对口服或注射剂型的氟喹诺酮类抗生素的潜在外周神经病变风险发出更强警告,必须更新相关药品的标签和患者用药指导。警告不适用于外用氟喹诺酮类制剂,因为这些制剂与神经病变无关。
树图思维导图提供《FDA发现喹诺酮类外周神经病变警告》在线思维导图免费制作,点击“编辑”按钮,可对《FDA发现喹诺酮类外周神经病变警告》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:1416f9d3b37a5cb08f92c1661e77cdb9
思维导图大纲
相关思维导图模版
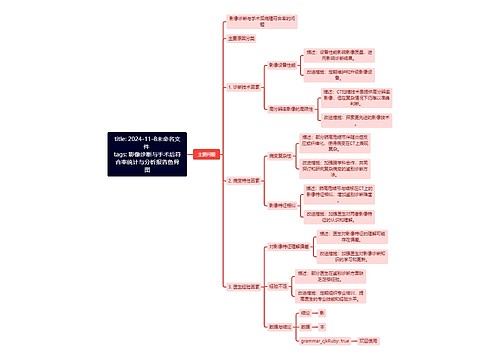
title: 2024-11-8未命名文件 tags: 影像诊断与手术后符合率统计与分析报告鱼骨图思维导图
 U880271396
U880271396树图思维导图提供《title: 2024-11-8未命名文件 tags: 影像诊断与手术后符合率统计与分析报告鱼骨图》在线思维导图免费制作,点击“编辑”按钮,可对《title: 2024-11-8未命名文件 tags: 影像诊断与手术后符合率统计与分析报告鱼骨图》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:f19c198bf7435acf7735ee5051a89d7b
骨料和海外双极驱动,一体化布局领跑行业思维导图
 U982199398
U982199398树图思维导图提供《骨料和海外双极驱动,一体化布局领跑行业》在线思维导图免费制作,点击“编辑”按钮,可对《骨料和海外双极驱动,一体化布局领跑行业》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:3b02aa55260be20b1cc2be8dc21730b9