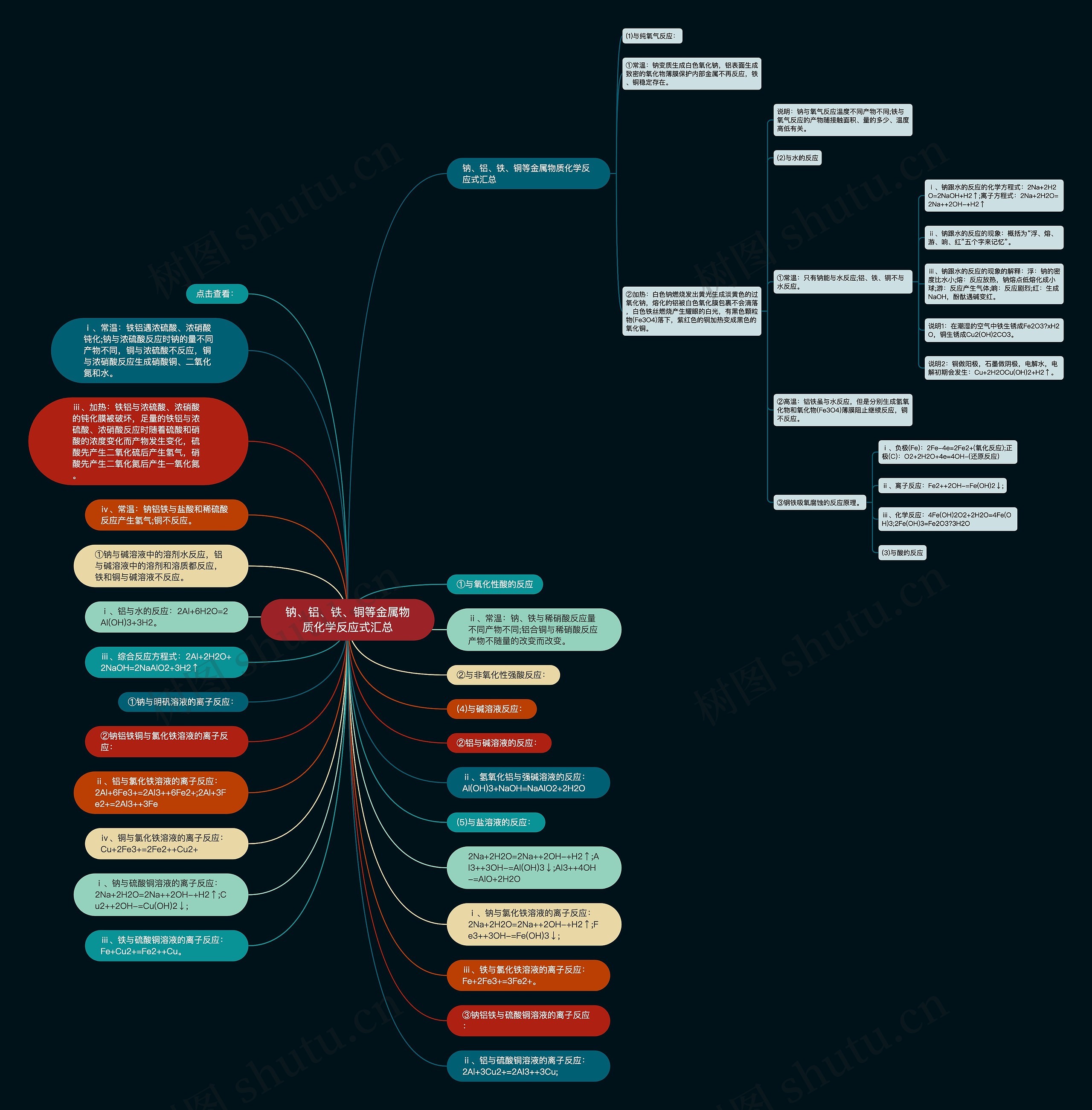
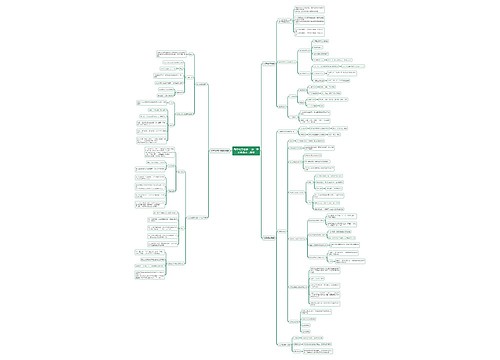
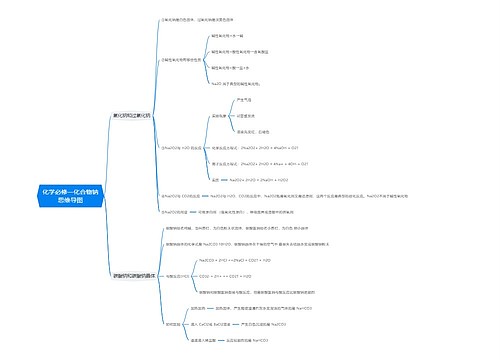
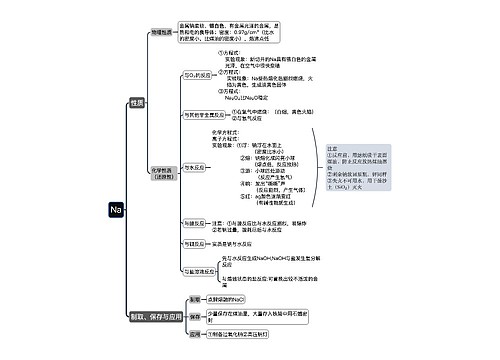
钠、铝、铁、铜等金属物质化学反应式汇总
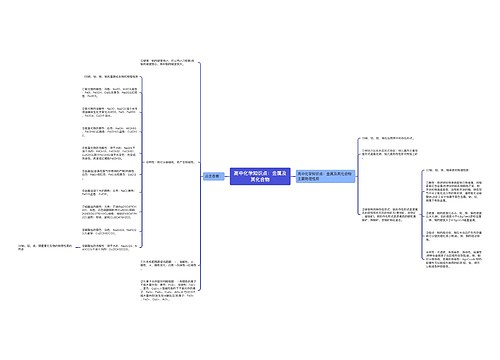
①常温:钠变质生成白色氧化钠,铝表面生成致密的氧化物薄膜保护内部金属不再反应,铁、铜稳定存在。
②加热:白色钠燃烧发出黄光生成淡黄色的过氧化钠,熔化的铝被白色氧化膜包裹不会滴落,白色铁丝燃烧产生耀眼的白光,有黑色颗粒物(Fe3O4)落下,紫红色的铜加热变成黑色的氧化铜。
说明:钠与氧气反应温度不同产物不同;铁与氧气反应的产物随接触面积、量的多少、温度高低有关。
①常温:只有钠能与水反应;铝、铁、铜不与水反应。
ⅰ、钠跟水的反应的化学方程式:2Na+2H2O=2NaOH+H2↑;离子方程式:2Na+2H2O=2Na++2OH-+H2↑
ⅱ、钠跟水的反应的现象:概括为“浮、熔、游、响、红”五个字来记忆”。
ⅲ、钠跟水的反应的现象的解释:浮:钠的密度比水小;熔:反应放热,钠熔点低熔化成小球;游:反应产生气体;响:反应剧烈;红:生成NaOH,酚酞遇碱变红。
说明1:在潮湿的空气中铁生锈成Fe2O3?xH2O,铜生锈成Cu2(OH)2CO3。
说明2:铜做阳极,石墨做阴极,电解水,电解初期会发生:Cu+2H2OCu(OH)2+H2↑。
②高温:铝铁虽与水反应,但是分别生成氢氧化物和氧化物(Fe3O4)薄膜阻止继续反应,铜不反应。
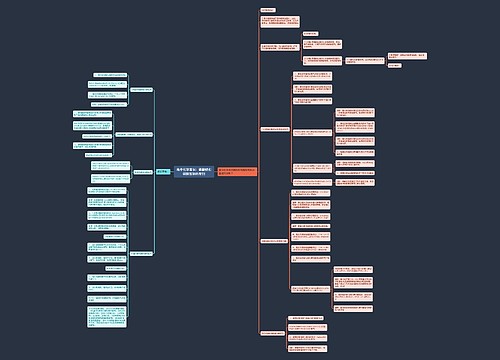
③钢铁吸氧腐蚀的反应原理。
ⅰ、负极(Fe):2Fe-4e=2Fe2+(氧化反应);正极(C):O2+2H2O+4e=4OH-(还原反应)
ⅱ、离子反应:Fe2++2OH-=Fe(OH)2↓;
ⅲ、化学反应:4Fe(OH)2O2+2H2O=4Fe(OH)3;2Fe(OH)3=Fe2O3?3H2O
ⅰ、常温:铁铝遇浓硫酸、浓硝酸钝化;钠与浓硫酸反应时钠的量不同产物不同,铜与浓硫酸不反应,铜与浓硝酸反应生成硝酸铜、二氧化氮和水。
ⅱ、常温:钠、铁与稀硝酸反应量不同产物不同;铝合铜与稀硝酸反应产物不随量的改变而改变。
ⅲ、加热:铁铝与浓硫酸、浓硝酸的钝化膜被破坏,足量的铁铝与浓硫酸、浓硝酸反应时随着硫酸和硝酸的浓度变化而产物发生变化,硫酸先产生二氧化硫后产生氢气,硝酸先产生二氧化氮后产生一氧化氮。
ⅳ、常温:钠铝铁与盐酸和稀硫酸反应产生氢气;铜不反应。
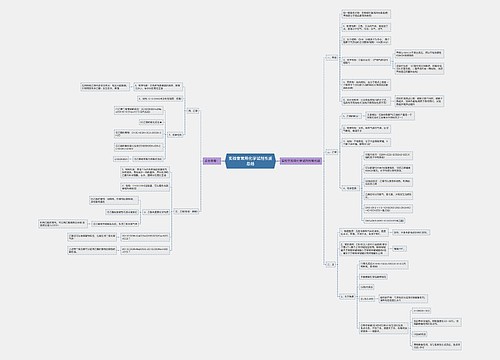
①钠与碱溶液中的溶剂水反应,铝与碱溶液中的溶剂和溶质都反应,铁和铜与碱溶液不反应。
ⅰ、铝与水的反应:2Al+6H2O=2Al(OH)3+3H2。
ⅱ、氢氧化铝与强碱溶液的反应:Al(OH)3+NaOH=NaAlO2+2H2O
ⅲ、综合反应方程式:2Al+2H2O+2NaOH=2NaAlO2+3H2↑
2Na+2H2O=2Na++2OH-+H2↑;Al3++3OH-=Al(OH)3↓;Al3++4OH-=AlO+2H2O
ⅰ、钠与氯化铁溶液的离子反应:2Na+2H2O=2Na++2OH-+H2↑;Fe3++3OH-=Fe(OH)3↓;
ⅱ、铝与氯化铁溶液的离子反应:2Al+6Fe3+=2Al3++6Fe2+;2Al+3Fe2+=2Al3++3Fe
ⅲ、铁与氯化铁溶液的离子反应:Fe+2Fe3+=3Fe2+。
ⅳ、铜与氯化铁溶液的离子反应:Cu+2Fe3+=2Fe2++Cu2+
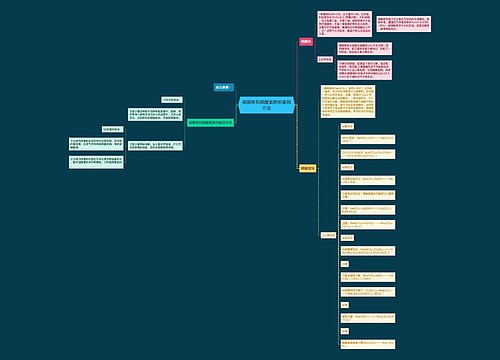
ⅰ、钠与硫酸铜溶液的离子反应:2Na+2H2O=2Na++2OH-+H2↑;Cu2++2OH-=Cu(OH)2↓;
ⅱ、铝与硫酸铜溶液的离子反应:2Al+3Cu2+=2Al3++3Cu;
ⅲ、铁与硫酸铜溶液的离子反应:Fe+Cu2+=Fe2++Cu。