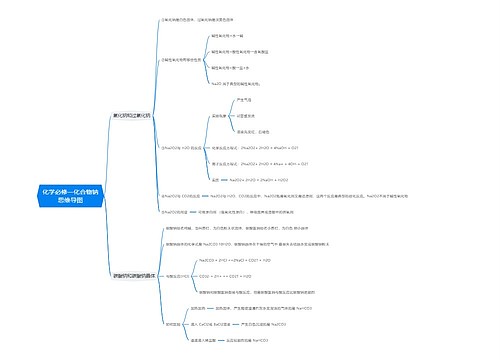
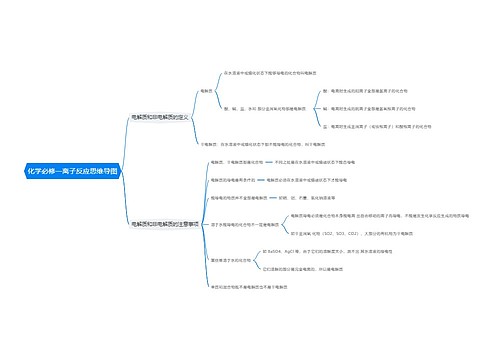
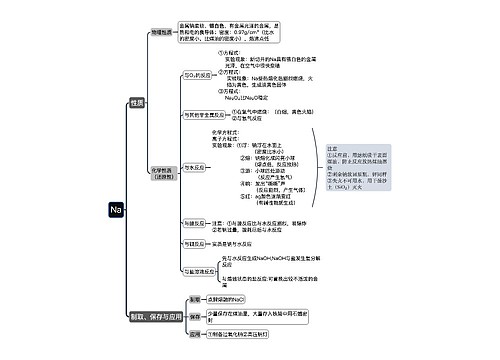
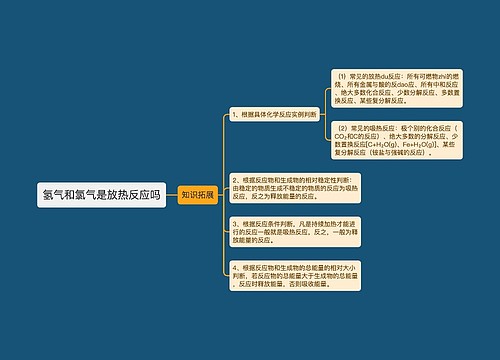
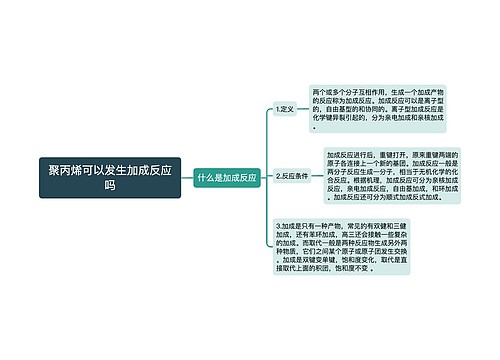
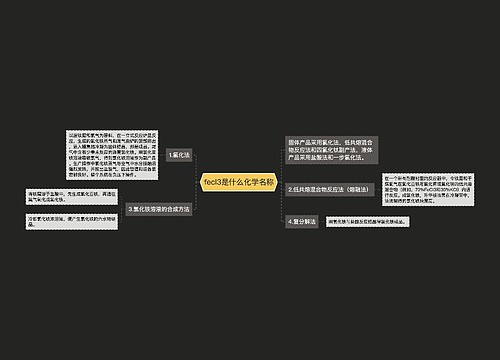
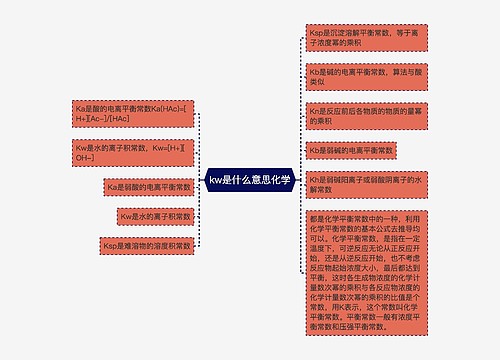
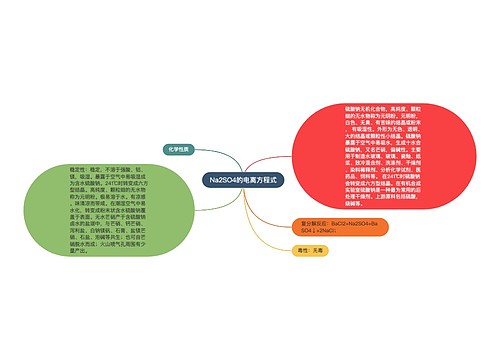
agcl与氨水反应离子方程式思维导图
心不动则不痛
2023-01-13

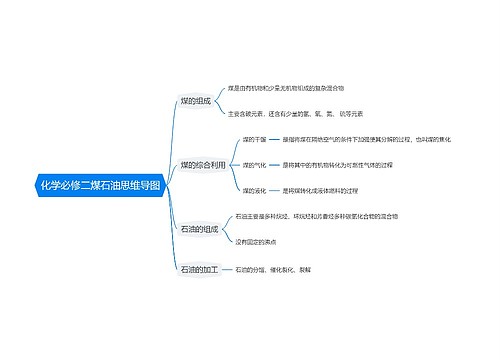
氯化银和氨水的反应没有离子方程式, 只能写化学反应方程式:
树图思维导图提供《agcl与氨水反应离子方程式》在线思维导图免费制作,点击“编辑”按钮,可对《agcl与氨水反应离子方程式》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:816cc83bd16fdbc9a91c4511f2238f21
思维导图大纲
相关思维导图模版
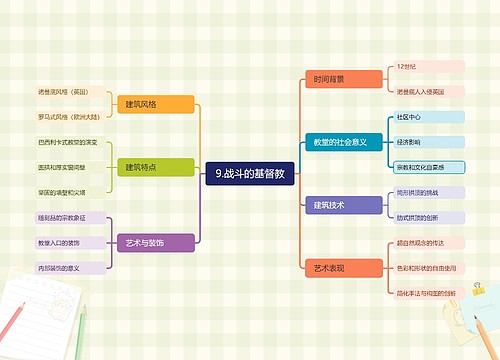
9.战斗的基督教思维导图
 U582679646
U582679646树图思维导图提供《9.战斗的基督教》在线思维导图免费制作,点击“编辑”按钮,可对《9.战斗的基督教》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:33d168acd0cd9f767f809c7a5df86e3a
第六章 群体传播与组织传播_副本思维导图
 U882673919
U882673919树图思维导图提供《第六章 群体传播与组织传播_副本》在线思维导图免费制作,点击“编辑”按钮,可对《第六章 群体传播与组织传播_副本》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:1672f555831e7d9a3bb2cf2fb792cb49