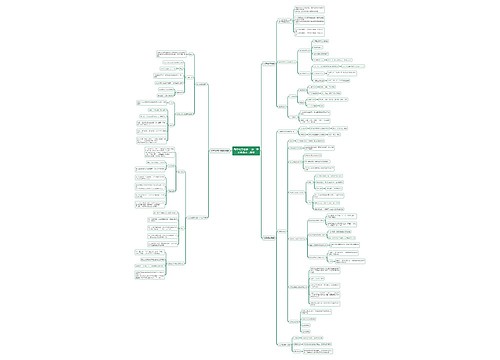
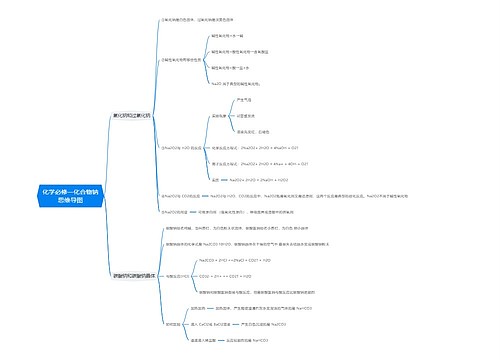
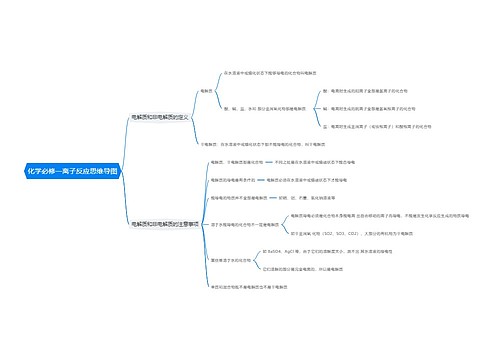
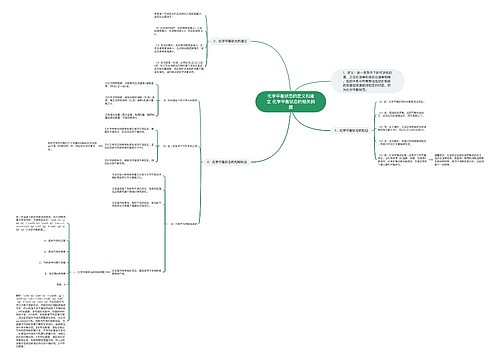
中和热的定义和理解 中和热的相关例题思维导图
心不动则不痛
2023-01-13

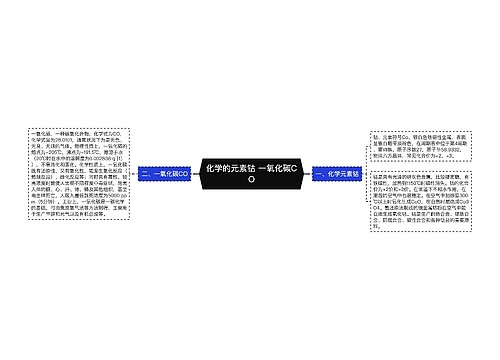
一、中和热的定义和理解
树图思维导图提供《中和热的定义和理解 中和热的相关例题》在线思维导图免费制作,点击“编辑”按钮,可对《中和热的定义和理解 中和热的相关例题》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:2548bf4a837a261d216a83531609c410
思维导图大纲
相关思维导图模版
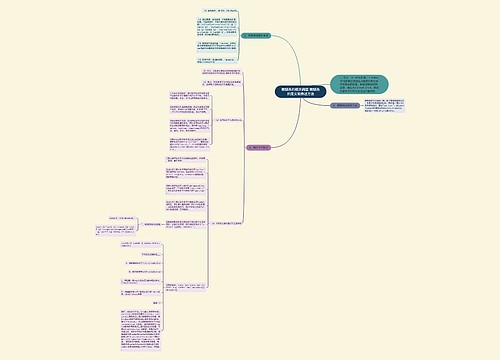
904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查思维导图
 U633687664
U633687664树图思维导图提供《904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查》在线思维导图免费制作,点击“编辑”按钮,可对《904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:10b9a8a2dd2fb4593f8130ef16c320fc

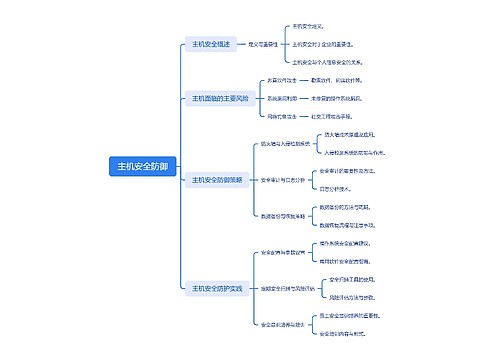
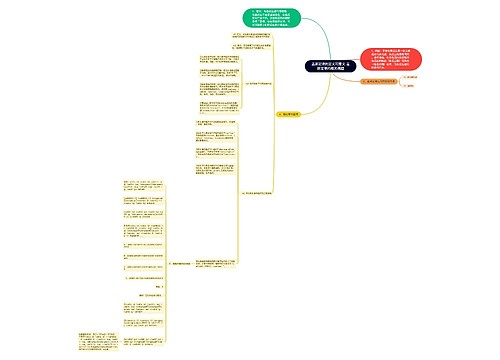
主机安全防御思维导图
 U882642901
U882642901树图思维导图提供《主机安全防御》在线思维导图免费制作,点击“编辑”按钮,可对《主机安全防御》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:fa34d4fe2f232e3cb5713f4995d45a66