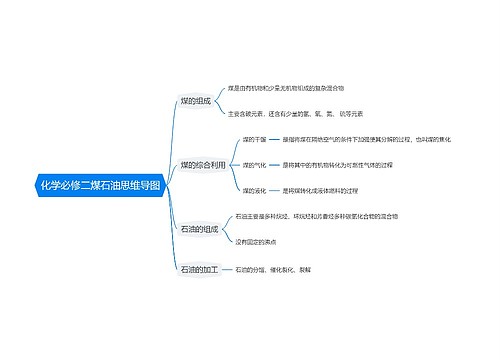
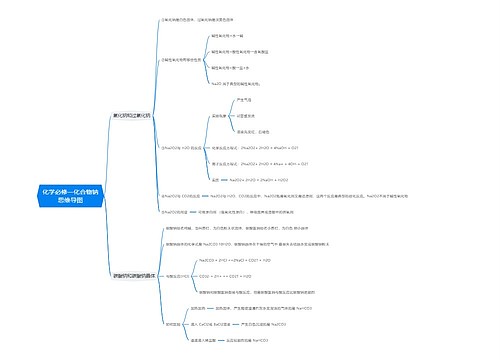
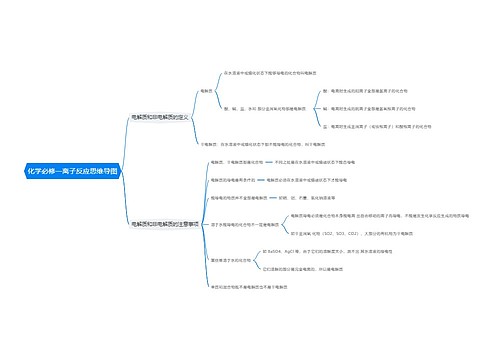
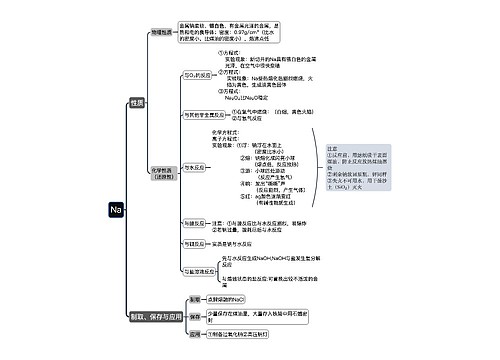
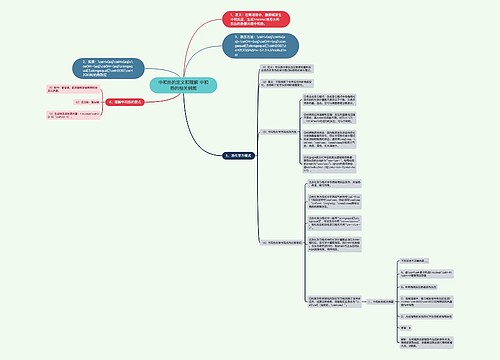
燃烧热的相关例题 燃烧热的定义和表述方法思维导图
心不动则不痛
2023-01-13
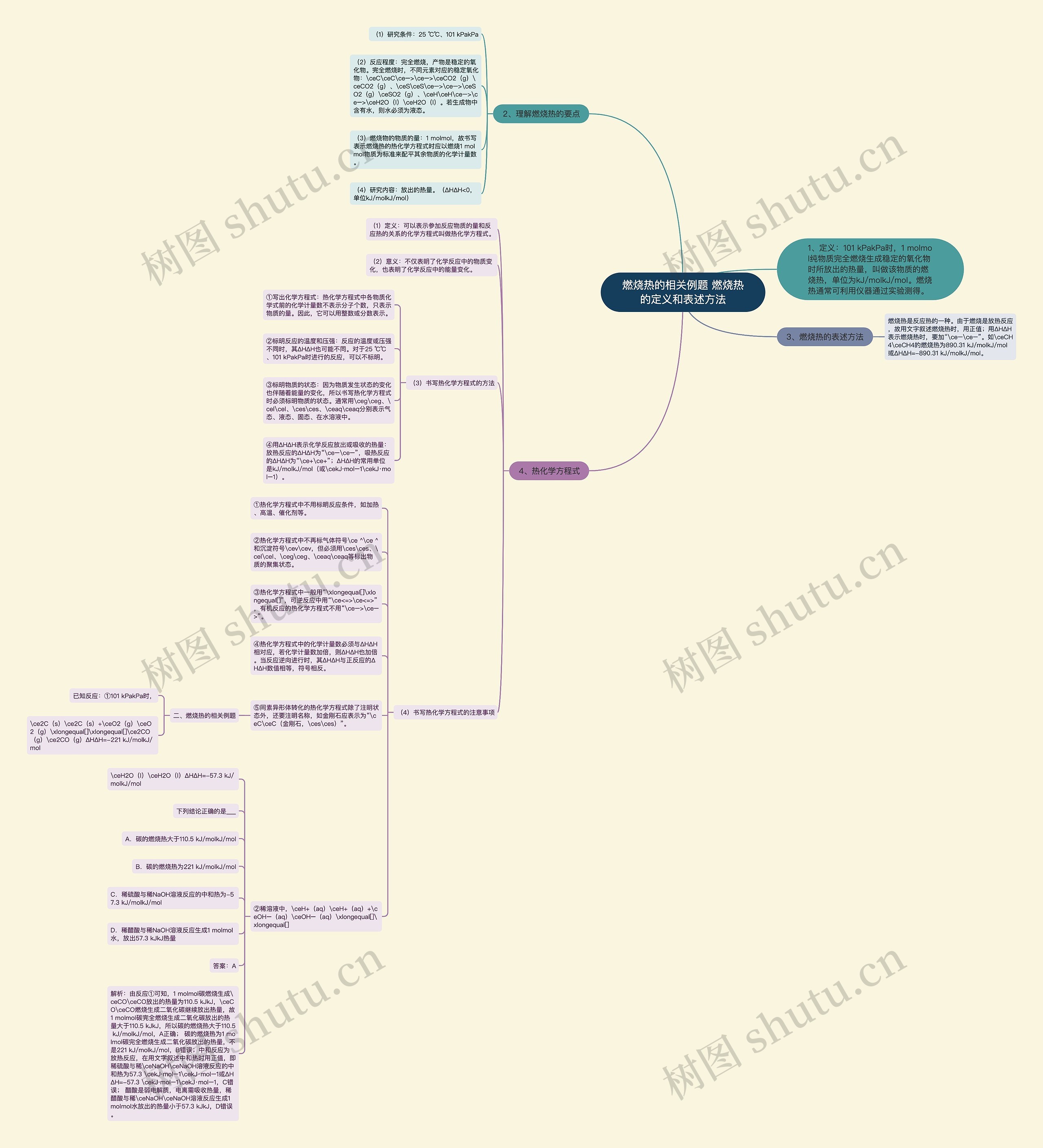
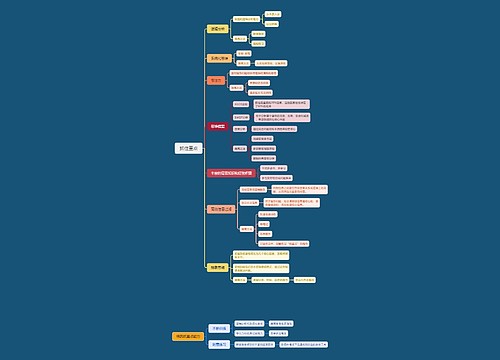
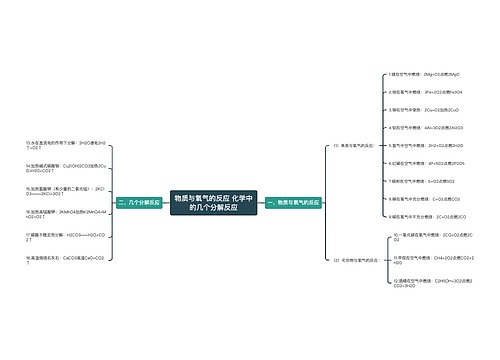
一、燃烧热的定义和表述方法
树图思维导图提供《燃烧热的相关例题 燃烧热的定义和表述方法》在线思维导图免费制作,点击“编辑”按钮,可对《燃烧热的相关例题 燃烧热的定义和表述方法》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:7368cfa6d58f9c477092b5e52bec3201
思维导图大纲
相关思维导图模版
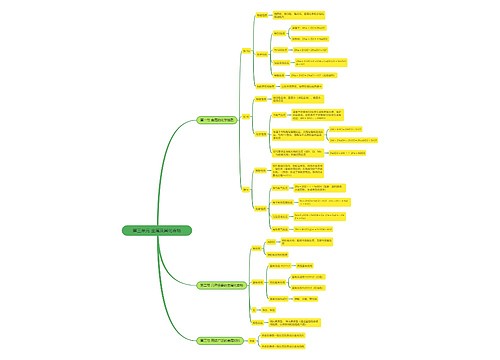
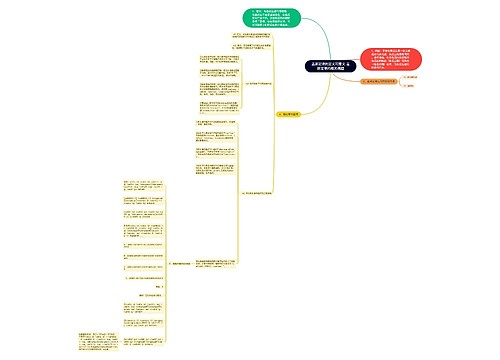
904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查思维导图
 U633687664
U633687664树图思维导图提供《904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查》在线思维导图免费制作,点击“编辑”按钮,可对《904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:10b9a8a2dd2fb4593f8130ef16c320fc

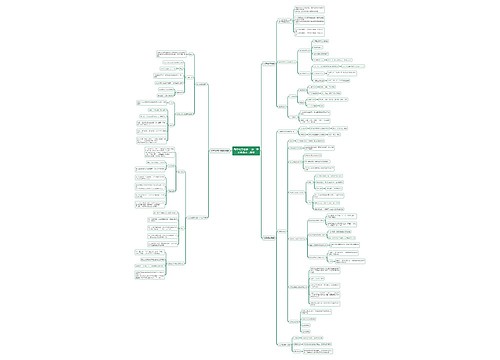
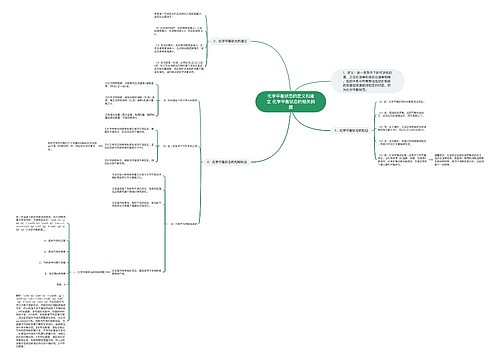
抓住重点思维导图
 ~漫埗陽茪~
~漫埗陽茪~树图思维导图提供《抓住重点》在线思维导图免费制作,点击“编辑”按钮,可对《抓住重点》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:4c49e4799ddf94a339c56e46eb96a826