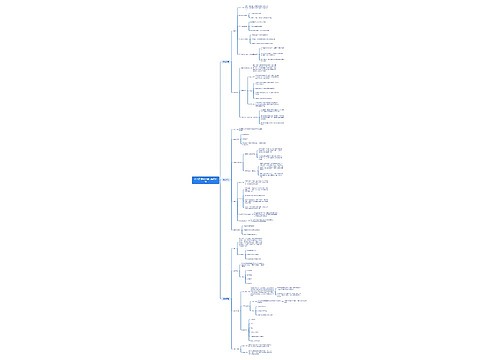
电化学与金属腐蚀思维导图
U420352262
2022-12-05

0
树图思维导图提供《电化学与金属腐蚀》在线思维导图免费制作,点击“编辑”按钮,可对《电化学与金属腐蚀》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:6777bab804c618b7d6874b26a4393b75
思维导图大纲
相关思维导图模版
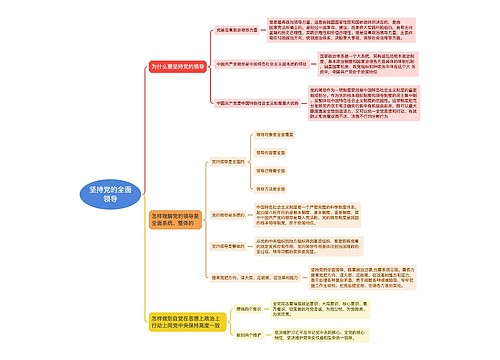
9.战斗的基督教思维导图
 U582679646
U582679646树图思维导图提供《9.战斗的基督教》在线思维导图免费制作,点击“编辑”按钮,可对《9.战斗的基督教》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:33d168acd0cd9f767f809c7a5df86e3a
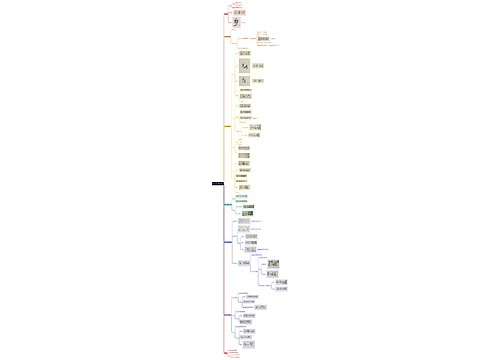
第六章 群体传播与组织传播_副本思维导图
 U882673919
U882673919树图思维导图提供《第六章 群体传播与组织传播_副本》在线思维导图免费制作,点击“编辑”按钮,可对《第六章 群体传播与组织传播_副本》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:1672f555831e7d9a3bb2cf2fb792cb49