crc年终工作计划通用6篇思维导图
花房姑娘
2023-05-09

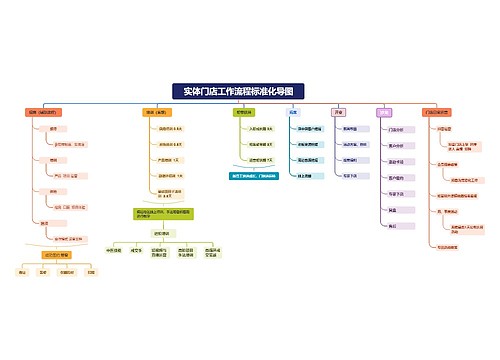
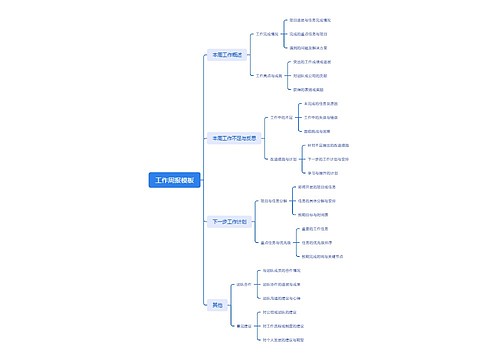
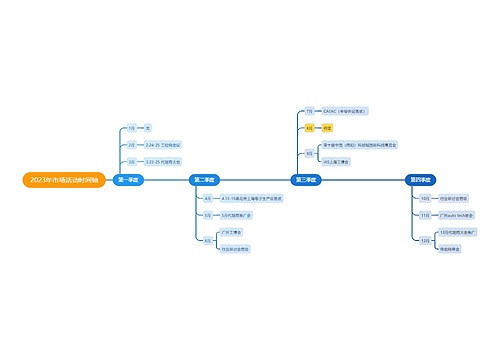
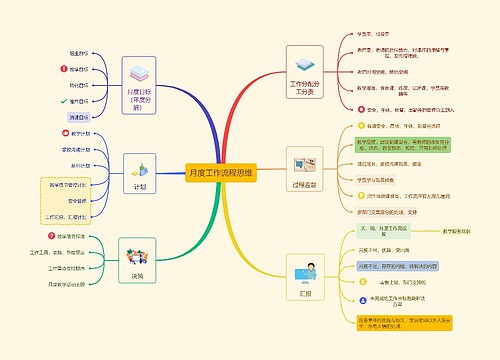
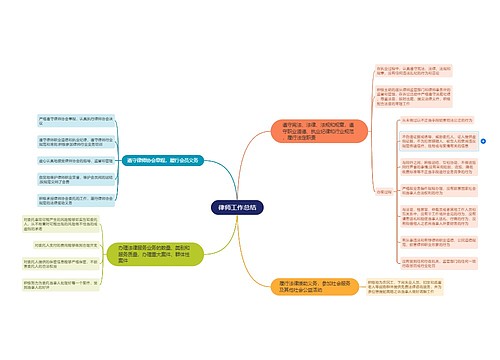
crc年终工作计划 第一篇2010年市场传媒协调员工作总结2010年即将接近尾声,作为市场传媒协调员,我的工作主要职能是协助市场传媒经理的协调处理酒店内各部门的宣传工作,与总部的沟通联系,以及对外媒体合作等相关事务,现将我的工作情况作如下汇报: 酒店内宣传工作:1、每日剪报,将与酒店相关信息、市场最新动向、以及政府、公...
树图思维导图提供《crc年终工作计划通用6篇》在线思维导图免费制作,点击“编辑”按钮,可对《crc年终工作计划通用6篇》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:b66fb981658fec724529f16958d146f7