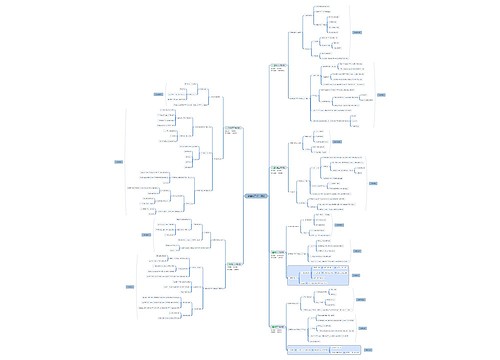
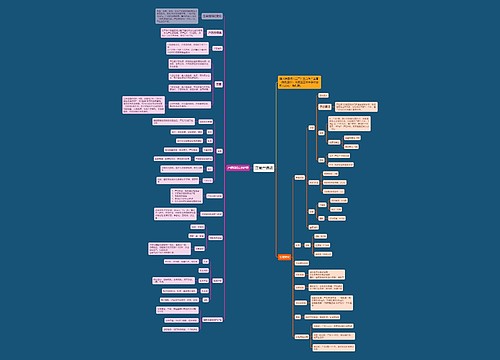
备战2018年执业药师考试:《法规》历年考点精选(4)思维导图
久别情深
2023-04-06

2018年执业药师考试已经进入至关重要的复习阶段,好的复习计划、对的复习资料更加有利于考试,树图网为大家整理了一些中药药物功效相关知识点,希望能够帮助大家顺利通关。
树图思维导图提供《备战2018年执业药师考试:《法规》历年考点精选(4)》在线思维导图免费制作,点击“编辑”按钮,可对《备战2018年执业药师考试:《法规》历年考点精选(4)》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:24e430a42d61f9317e1d2a2f6246a7c9
思维导图大纲
相关思维导图模版
904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查思维导图
 U633687664
U633687664树图思维导图提供《904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查》在线思维导图免费制作,点击“编辑”按钮,可对《904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:10b9a8a2dd2fb4593f8130ef16c320fc

销售经理半年规划思维导图
 U582121265
U582121265树图思维导图提供《销售经理半年规划》在线思维导图免费制作,点击“编辑”按钮,可对《销售经理半年规划》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:e614d6bcf03e9318109240a18697c5d1