蛋白质元素介绍脑图思维导图
U947378719
2023-10-15
蛋白质
氨基酸
营养物质
氨基酸与蛋白质营养物质全内容分解
树图思维导图提供《蛋白质元素介绍脑图》在线思维导图免费制作,点击“编辑”按钮,可对《蛋白质元素介绍脑图》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:1aaba2003e7c4041d3fe5aefeeb494b8
思维导图大纲
相关思维导图模版
蛋白质思维导图模板大纲
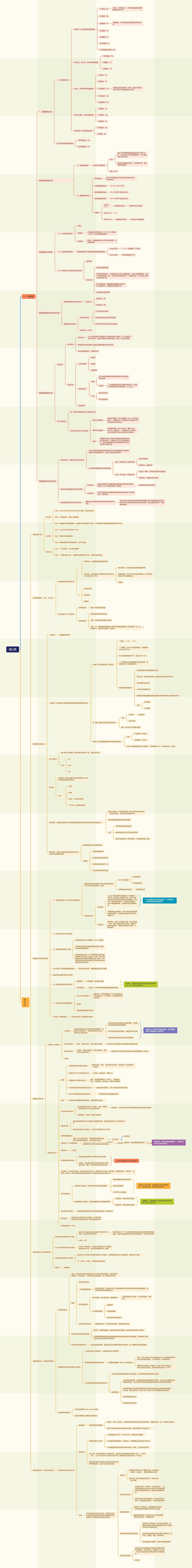
一、氨基酸
1、氨基酸的分类
(1)氨基酸的分类
a.非极性,疏水脂肪族R基氨基酸
1.甘氨酸 Gly
无手性、空间位阻小、不会与其他氨基酸残基的侧脸发生作用
2.丙氨酸 Alla
3.脯氨酸 Pro
亚基氨酸 ,参与形成的肽键容易出现顺式构型
4.缬氨酸 Val
5.亮氨酸 Leu
6.异亮氨酸 Ile
7.甲硫氨酸/蛋氨酸 Met
b.非极性、疏水性、芳香族R基氨基酸
1.苯丙氨酸 Phe
2.酪氨酸 Tyr
3.色氨酸 Trp
c.极性、不带电荷的R基氨基酸
1.丝氨酸 Ser
2.苏氨酸 Thr
3.半胱氨酸 Cys
侧链有反应性很高的—SH基,能够在两条肽链之间或之内形成稳定的二硫键
4.天冬氨酸 Asn
5.谷氨酰胺 Gln
d.带正电荷的、碱性R基氨基酸
1.赖氨酸 Lys
2.精氨酸 Arg
3.组氨酸 His
e.带负电荷、酸性R基氨基酸
1.天冬氨酸 Asp
2.谷氨酸 Glu
(2)不常见的蛋白质氨基酸
1.硒半胱氨酸 Sec
2.吡咯赖氨酸 Pyl
氨基酸的酸碱性质
(1)氨基酸的解离
兼性离子/偶极离子
概念
R基不含可解离基团的氨基酸溶于中性PH水中,占优势的分子形式是兼性离子,极少数以非离子形式存在
兼性离子既起酸的作用,又起碱的作用,被称为两性电解质
图例(p47)
(2)氨基酸的等电点
等电点概念
缩写为PI,氨基酸处于静电荷为0时的特征PH称为等电点
中性氨基酸等电点
PI=1/2(PK1+PK2)
酸性氨基酸等电点
PI=1/2(P两个最小的之和)
碱性氨基酸等电点
PI=1/2(P两个最大的之和)
环境PH
环境PH>PI
氨基酸带负电荷
在电场中向正极移动
环境PH=PI
0
环境PH<PI
氨基酸带正电荷
在电场中向负极移动
氨基酸的化学反应
(1)a-羧基参加的反应
1.酯化
2.酰氯化
a-羧基容易与五氯化磷(PCL5)和二氯亚砜(SOCL2)反应生成氨基酰氯
3.酰胺化
在体外,氨基酸酯在无水乙醇中与氨作用,形成氨基酰胺
(2)a-氨基参加的反应
氨基酸的游离a-氨基酸可被酰氯或酸酐酰化
sanger反应
2,4—二硝基氟苯(DFNB)
Edman反应
苯异硫氰酸酯(PITC)
(3)a-氨基和a-羧基共同参与的反应
成肽反应
与茚三酮
检测和定量氨基酸
茚三酮时强氧化剂,在弱酸性溶液中与a-氨基酸共热,引起a-氨基酸脱氨,反应产物是相应的醛、氨、二氧化碳和还原茚三酮,产生的氨与另一个茚三酮分子反应生成紫色产物
两个亚氨基酸、脯氨酸和羟脯氨酸与茚三酮,并不释放NH3,而直接生成亮黄色产物
荧光胺反应成蓝绿色
氨基酸的旋光性和光谱性质
氨基酸的旋光性和立体化学
羧基在上
氨基在左 L型
氨基在右 D型
氨基酸的光谱性质
紫外吸收光谱
1.可见光区无光吸收
只有芳香族再近紫外区有光吸收
所有在红外区与远紫外区有光吸收
核磁共振(NMR)
氨基酸的混合分析
分配层析
基本原理
分配定律
当一种溶剂在两个给定的互不相溶的溶剂中分配时,在一定温度下达到平衡后,溶液在两相中的浓度比值为一常数,称为分配系数
溶液的有效分配系数可以通过调整两相的体积比来改变
分配系数差异越大,越容易分开
主要种类
1.分配柱层析
洗脱剂
洗出液
洗脱曲线
2.[滤]纸层析
原理
由于各种氨基酸在溶剂系统里就有不同的比移值/移动率
比移值
一个氨基酸的层析中点离原点的距离(x)与展开溶剂的前沿离原点的距离(x+y)之比
分类
单向纸层析谱
双向纸层析谱
3.薄层层析
离子交换层析
是一种基于氨基酸电荷行为的层析方法
层析柱中填充离子交换树脂
阳离子交换树脂
含有酸性基团—SO3H(强酸型)或—COOH(弱酸型),可解离出H+,能跟溶液中其他阳离子发生交换而结合在树脂上
阴离子交换树脂
含有碱性基团—N(CH3)3OH(强碱)或—NH3OH(弱碱型),可解离出OH-,能跟溶液中其他阴离子发生交换而结合在树脂上
原理
氨基酸在树脂上结合的牢固程度基氨基酸与树脂间的亲和力,主要取决于它们之间的静电引力,其次是氨基酸侧链与树脂基质聚苯乙烯之间的疏水相互作用。
氨基酸序列与生物进化
序列同源性、同源蛋白和蛋白质家族
当两个基因有着明显的序列相似的DNA中核苷酸序列或其编码蛋白质中的氨基酸序列,则说它们具有序列同源性
它们编码的蛋白质称为同源蛋白质
直向(定向进化)同源蛋白质
来自不同物种
结构相似,功能相同
共生(平行进化)同源蛋白质
来自同一物种,由于拷贝序列渐变引起的
结构相似,功能相似但不相同
同源蛋白质氨基酸序列的物种差异
可变残基
对蛋白质功能不大重要的氨基酸残基在进化期间可能发生改变,即一种残基可被另一种替换
能够提供追踪进化的信息
不变残基
对它生物功能所必须的氨基酸残基在进化过程中几乎保持不变,是保守的
同源蛋白质具有共同的进化起源
细胞色素c和其他同源蛋白质的序列资料分析得出
来自任何两个物种的同源蛋白质的氨基酸序列之间的残基差异数与这两个物种之间的系统发生差异时成比例的。进化位置差异越大,残基差异数越大
蛋白质
蛋白质的水解
酸水解
方法:6mol/mlHCL或4mol/mlH2SO4水解,回流煮沸20h
优点:不引起消旋,得到L-型氨基酸
缺点:色氨酸完全被废酸破坏,丝氨酸以及苏氨酸部分分解,天冬酰胺和谷氨酰胺的酰氨基被水解下来
碱水解
方法:5mol/mlNaOH共煮10~20h
优点:碱性条件色氨酸稳定
缺点:氨基酸遭到不同程度的破坏,且产生消旋
酶水解
优点:不产生消旋,也不破坏氨基酸
缺点:一种酶水解不完全,需要多种水解酶共同作用,水解所需时间较长
蛋白质的组成、分类、分子大小
蛋白质的化学组成和分类
1
简单蛋白:仅由氨基酸组成的蛋白质
缀合蛋白:除氨基酸之外的其他化学成分作为永久型结构的一部分
辅基/配体:在蛋白质功能方面起重要作用
脱辅基蛋白:除去了非共价结合的辅基,剩下的蛋白质部分称为脱辅基蛋白
全蛋白
2
纤维状蛋白
球状蛋白
膜蛋白
蛋白质的分子大小和形状
单体蛋白质
仅由一条多肽链组成的
寡聚蛋白质
由两条或多条多肽链构成
亚基:其中每条多肽链称为亚基
注意:eg:胰岛素的两条链和r-球蛋白的四条链都是由二硫键交联在一起,这种情况下,多肽链不称亚基,而称链
子主题 1
蛋白质的结构层次
一级结构
氨基酸排列顺序
二级结构:肽链主链中局部肽段借助氢键形成的周期性结构
a螺旋(常见的蛋白质二级结构)
二面角( =-57, =-47 )
一个螺圈,包含3.6个氨基酸残基,沿螺旋轴方向上升0.54nm
每个残基绕轴旋转100°,沿轴上升0.15nm
一个a螺旋段中相邻螺旋圈之间形成氢键,氢键的取向几乎与螺旋轴平行
影响a螺旋的稳定性
氨基酸残基形成a螺旋固有倾向性
R基之间,特别是间隔3或4个残基的R基之间的相互作用
相邻R基的庞大体系
Pro和Gly残基的存在
螺旋段末端的氨基酸残基和a螺旋所特有的电偶极之间的相互作用
分类
左手螺旋
右手螺旋
β-折叠(把多肽链组织成片层结构
分类
平行β片
更加规则
反平行β片
β股:β片中每个肽链称为β股
β转角(某些氨基酸残基转折或回环的地方)
分类
Ⅰ型β转角(O在内)
Ⅱ型β转角(O在外)
涉及4个氨基酸残基,第i个残基的C、O双键和第i+3N、H单键形成一个氢键
超二级结构
两个或多个相邻的二级结构单元组合在一起,彼此相互作用
分类
aa
βaβ
ββ
结构域
多肽链在二级结构或超二级结构的基础上形成三级结构的局部折叠区域
分类
全a类
全β类
a/β类(a 与β相互掺和)
a+平行β(a与β相互聚集)
三级结构:是指多肽链借非共价折叠成具有折叠成具有特定走向的完整球状实体
肽键不可旋转,与肽键关联的6个原子构成肽基或肽单位,具有刚性性质,称为肽平面或酰胺平面
多肽链的折叠受到空间位阻的限制
方法
X射线衍射晶体结构测定
核磁共振生物大分子动态结构研究
溶液中构象研究(紫外差光谱、荧光偏振和圆二色性
四级结构:具有三级结构的亚基借助非共价力彼此缔合成寡聚蛋白质
即亚基的聚合方式或组织方式
优越性
1.增强结构稳定性
2.提高遗传经济性和效率
3.使催化集团汇聚在一起
4.具有协同性和别构效应
蛋白质化学测序的策略
(1)确定蛋白质分子中不同多肽链的数目
根据蛋白质末端残基的分析可以确定蛋白质分子中不同多肽链的数目(种类)
只含一种多肽链
单体蛋白质
同多聚蛋白质
含两种或多种多肽链
杂多聚蛋白质
末端残基分析
N端残基
sanger:多肽链游离末端氨基与二硝基氟苯(FDNB)反应生成二硝基苯多肽。由于FDNB与氨基反应生成的键对酸远比肽键稳定,因此DNP-多肽经酸水解后,N端残基以黄色的DNP-氨基酸被释放,其余的都成为游离氨基酸
丹磺酰氯和达磺酰氯,由于这些化合物具有强烈的荧光基因,生成的衍生物比DNP衍生物更易检出
C端残基
羧肽酶法:其是一类肽链外切酶,称为外肽酶,它专一的从肽链的C端逐个降解,测定逐个释放的氨基酸,可推断C端残基和C端的一小段肽序列
(2)拆分蛋白质分子的多肽链
(3)断裂多肽链内的二硫键
过甲酸氧化法或二硫苏糖醇(DTT)还原法
过甲酸可以定量打开胱氨基酸残基的二硫键,生成磺基丙氨酸残基
还原剂巯基化合物,DTT也能断裂生成半胱氨酸残基以及对应的二硫化物(注意:因为半胱氨酸残基中的巯基极易被氧化成二硫键,所以需要用卤化烷如碘乙酸或碘乙酰胺等试剂与巯基反应把它保护起来
(4)分析每一多肽链的氨基酸组成
将样品完全水解,用氨基酸自动分析仪测定
(5)鉴定多肽链的N端和C端残基
(6)裂解多肽链成较小的片段
酶裂解法
蛋白酶是一类肽链内切酶
化学裂解法
溴化氰,它只断裂甲硫氨酸残基的羧基侧肽键
(7)测定各肽段的氨基酸序列
Edman化学降解法
降解试剂:苯异硫氰酸酯(PITC)与肽链反应只标记和除去一个N端残基,肽链的其余肽键不被水解
质谱法
根据基因核苷酸序列推测
(8)确定二硫键的位置
对角线电泳(含二硫键偏离对角线)
蛋白质分离纯化
分离纯化一般程序
1.前处理
首先要求把蛋白质从原来的组织或细胞中一溶解的状态释放出来,并保持原来的天然状态,避免丢失生物学活性
动物材料剔出结缔组织包括脂肪组织,电动捣碎机破碎或用超声处理破碎
种子材料应先去壳和种皮,避免受单宁等污染
油料材料应该先用低沸点如乙醚等脱脂
2.粗分级分离
盐析、等电点沉淀、有机溶剂分级分离
不适用于沉淀法和盐析法可用超过滤或凝胶过滤
3.细分级分离
柱层析(凝胶过滤层析、离子交换层析、吸附层析以及亲和层析)
必要时可以采用电泳法如凝胶电泳或等电聚焦进一步纯化
4.结晶
分离纯化方法
原理
1.根据溶解度不同的分离方法
等电点沉淀、盐析、有机溶剂分级分离、两相分配(如分配层析)和结晶
2.根据分子大小不同的分离方法
超过滤、凝胶过滤、超离心法
3.根据电荷不同的分离方法
电泳、聚丙烯凝胶电泳(PAGE)、毛细血管电泳、等电聚集、双向电泳)和离子交换层析
4.以疏水相互作用为基础的分离方法
疏水相互作用层析、SDS-PAGE和染料亲和层析
5.基于生物配基亲和力的分离方法
各种亲和层析和金属螯合层析
盐溶
中性盐可以增加蛋白质的溶解度,这种现象称为盐溶
有机溶剂分级分离
与水互溶的有机溶剂(如甲醇、乙醇、丙酮等)能使蛋白质在水中的溶解度降低
在室温下,这些有机溶剂不仅能引起蛋白质沉淀而且伴随变性
主要原因之一改变了介质的介电常数
透析和超滤
透析是利用蛋白质分子不能通过半透膜的性质,使蛋白质和其他小分子物质分离开
超过滤是利用压力或离心力,强行使水和其他小分子分离
密度梯度超速离心
凝胶过滤(大小排阻层析)
它是根据多孔介质对不同大小和不同形状分子的排阻能力不同来分离蛋白质混合物的
内部为网状结构,比凝胶孔径大的不能进入孔径,最先流出柱外
凝胶电泳
子主题 1
等电聚焦和双向电泳
等电聚焦是在具有PH梯度的介质中进行的
加样后,蛋白质混合物在外电场的作用下将移动并各自”聚焦“在与其等电点相等的PH处
双向电泳:有些混合物进行一次电泳不能完全分开,这种情况下可在第一次电泳后,将凝胶条切下,旋转90°,进行第二次电泳。现在多指等电聚焦和随后的SDS-凝胶电泳相结合的分离方法
离子交换层析
纤维素离子交换剂:采用纤维素作为交换剂的基质
具有松散的亲水性网状结构
有较大的表面积
大分子可以自由通过
交联葡萄离子交换剂:采用交联葡萄作为交换剂的基质
分段洗脱:跳跃式的分段改变
梯度洗脱:渐进式的连续改变
疏水相互作用层析
根据蛋白质表面的疏水性差别发展起来的一种纯化技术
亲和层析
蛋白质分子对其配体分子具有专一性识别或称生物学亲和力建立起来的一种有效的纯化方式
高校液相层析(HPLC)
蛋白质相对分子质量的测定
凝胶过滤法测定相对分子质量
蛋白质分子通过凝胶柱的速度并不取决于分子质量,而是它的斯托克半径
如果蛋白质与一个非水化球体具有相同的过柱速度即相同的洗脱速度,则这种蛋白质具有与此球体相同的半径,称为斯托克半径
LgMr=a-bV
SDS-PAGE测定相对分子质量
SDS是一种变性剂,它能破坏蛋白质分子中的氢键和疏水相互作用,而巯基苏糖醇能打开二硫键
沉降速度法测相对分子质量
蛋白质分子在溶液中受到强大的离心力作用时,如果蛋白质密度大于溶液密度,蛋白质分子沉降
10-13作为一个单位,称为斯维德贝格单位
质谱法
精确度高
蛋白质的变性、折叠和结构预测
蛋白质的变性
实质:蛋白质变性的实质是蛋白质分子中的次级键被破坏,引起天然构象解体(不涉及肽键、二硫键等共价键的破裂,仅一级结构仍然完好
现象
生物学活性丧失
一些侧链基团暴露
蛋白质变形后,有些原来在分子内部包藏而不易与化学试剂起反应的侧链基团,由于结构伸展松散而暴露出来
理化性质改变
由于变性后,疏水基外露,溶解度降低
一般在等电点时不溶解,分子相互凝集,形成沉淀。
不对称程度增高
粘度增加
扩散系数降低
旋光和紫外吸收的变化
生物化学性质改变
蛋白质变性后,分子结构伸展松散,易被蛋白酶水解
变性剂使蛋白质变性的机制
变性剂:尿素和盐酸胍,能与多肽主链竞争氢键,因此破坏蛋白质的二级结构
可能更重要的原因是尿素或盐酸胍增加非极性侧链在水中的溶解度,因而降低了维持蛋白质三级结构的疏水相互作用
蛋白质的变性复性学说
当变性因素去除后,变性蛋白质又可重新回复到天然构象,这一现象称为蛋白质的复性
氨基酸序列规定蛋白质的三级结构
二级结构决定于短程序列,三级结构决定于长程序列
核糖核酸酶的变性和复性实验
牛胰核糖核酸酶(RNase A)复性实验
变性:RNase在8mol/ml的尿素或6mol/ml的盐酸胍存在下用β-巯基乙醇处理后,分子内的四个二硫键被断裂。
用透析方法将尿素(盐酸胍)以及β-巯基乙醇除去后,RNase活性又可恢复,达到原来活性的95%~100%
二硫键在稳定蛋白质构象中的作用
二硫键对肽链的正确折叠并不是必要的,但它对稳定折叠态结构作出贡献
自装配原则
三维结构限制因素:肽键的硬度即肽键的刚性平面性质、肽链中疏水基和亲水基的数目和位置、带正电荷和负电荷的R基数目和位置以及溶剂和其他溶质等
这些限制因素下通过R基团的彼此相互作用以及R基团与溶剂和其他溶质相互作用,最后达到平衡,形成了在一定条件下热力学最稳定的空间结构
蛋白质的折叠热力学
蛋白质的折叠动力学
蛋白质的结构预测
二级结构的预测-Chou-Fasman算法
三级结构的预测-折叠的计算机模拟
蛋白质的性质、分离纯化和鉴定
蛋白质在水溶液中的行为
酸碱性质
蛋白质是两性电解质
等电点:在某一PH值下,蛋白质所带的正电荷与负电荷恰好相等,即静电荷为0,这一PH值称为等电点
环境PH为等电点时蛋白质胶体不稳定(等电点时破坏了带电状态)
胶体性质
保持稳定的三个条件
1.分散相质点大小在1~100nm之间,此时其动力学稳定
2.分散相带同种静电荷,互相排斥,不易聚集成大颗粒而产生沉淀
3.分散相的质点能与溶剂形成溶剂化层(例如,与水形成水化层)
水化作用:蛋白质溶液是一种亲水胶体,蛋白质分子表面的亲水基团如-NH2、-COOH、-OH、-CO-NH-等于水分子发生水化作用,使蛋白质分子表面形成一个水化层
蛋白质溶液由于蛋白质分子具有水化层于电荷两种稳定因素,所以作为胶体相当稳定
沉淀
在蛋白质溶液中加入脱水剂,或者改变溶液PH达到蛋白质的等电点使质点的静电荷为0,蛋白质分子聚集成大颗粒而形成沉淀
盐析法
在蛋白质溶液中加入大量的中性盐(如硫酸铵、硫酸钠、氯化钠),使蛋白质脱去水化层
盐析沉淀一般不引起蛋白质变性。当除去盐后,复可溶解
有机溶剂沉淀法
极性有机溶剂(如甲醇、乙醇或丙醇等),因引起蛋白质脱去水化层以及降低介电常数而增加异性电荷的相互作用,使蛋白质容易聚集沉淀
有机溶剂可引起蛋白质变性,但如果在低温下操作,并且缩短处理时间,可使变性速度减慢
重金属沉淀法
当溶液PH>等电点时,蛋白质颗粒带负电荷,这样容易与金属阳离子结合成不溶性盐
误服金属盐的病人可口服大量牛乳与重金属离子形成不溶性盐,在服用催吐剂
生物碱试剂和某些酸沉淀法
当溶液PH<等电点时,蛋白质带正电荷,容易跟生物碱试剂和某些酸的酸根负离子发生反应生成不溶性盐而沉淀
生物碱试剂是指能引起生物碱沉淀的试剂(单宁酸、苦味酸、钨酸、碘化钾等)
某些酸是指三氯醋酸、磺基水杨酸和硝酸等
加热变性沉淀法
加热变性沉淀可能是由于惹变性使得蛋白质天然构象解体,疏水基外露,因而破坏了水化层,同时由于蛋白质处于等电点破坏了其带电状态
制豆腐
断裂后,所得肽段混合物使用凝胶过滤凝胶电泳、HPLC等方法分离纯化思维导图模板大纲
DNP-氨基酸经有机溶剂提取后,可用纸层析、薄层层析或高效液相色谱思维导图模板大纲
选择适当方法将组织或细胞破碎,有时需要差速离心将细胞成分分离出来思维导图模板大纲
用显色剂(考马斯亮蓝或氨基黑),侵染后即可显示出蛋白质条带思维导图模板大纲
此技术特别适用于同工酶的鉴定思维导图模板大纲
适用于大分子分离,交换容量比离子交换树脂大,洗脱条件温和,蛋白质回收率较高思维导图模板大纲
容量更大,即能跟据分子的净电荷数量又能根据分子大小进行分离思维导图模板大纲
原理:在外电场作用下,荷电颗粒将向着与其电荷符号相反的电极移动,这种现象称为电泳思维导图模板大纲
电泳类型
区带电泳
凝胶电泳(聚丙烯酰胺凝胶电泳)
查看更多
相似思维导图模版
首页
我的文件
我的团队
个人中心