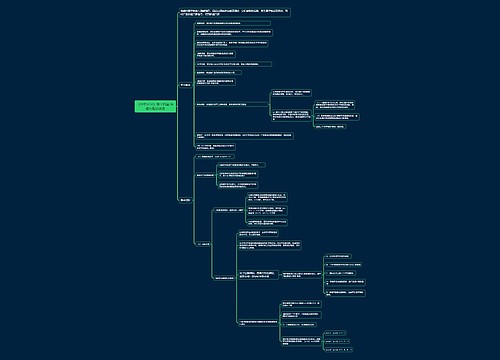
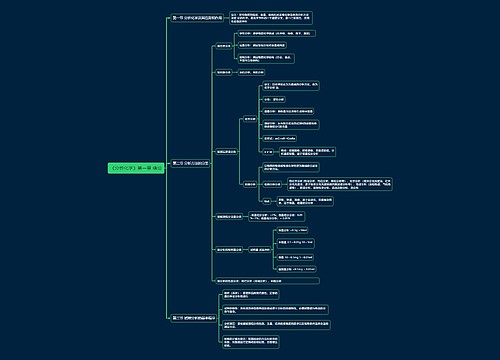
《分析化学》第四章 酸碱滴定法思维导图
divlo_
2022-11-16

滴定突跃和突跃范围:在化学计量点前后±0.1%,溶液浓度及其相关参数发生的急剧变化为滴定突跃。突跃所在的范围称为突跃范围。
树图思维导图提供《《分析化学》第四章 酸碱滴定法》在线思维导图免费制作,点击“编辑”按钮,可对《《分析化学》第四章 酸碱滴定法》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:3d8cbfd79dfee645079a5415e23ca1e5
思维导图大纲
相关思维导图模版
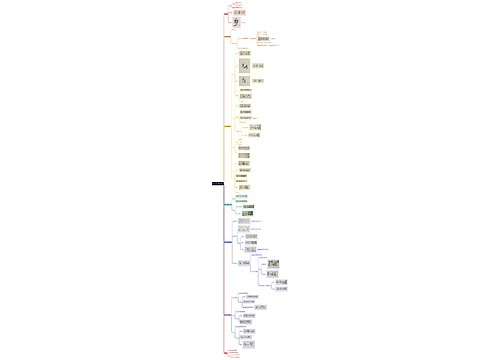
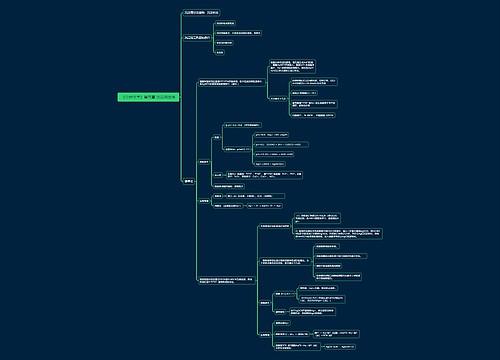
《分析化学》第十五章 质谱法思维导图
 divlo_
divlo_树图思维导图提供《《分析化学》第十五章 质谱法》在线思维导图免费制作,点击“编辑”按钮,可对《《分析化学》第十五章 质谱法》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:250c732e063fa8626ea4de0f1a4438cb

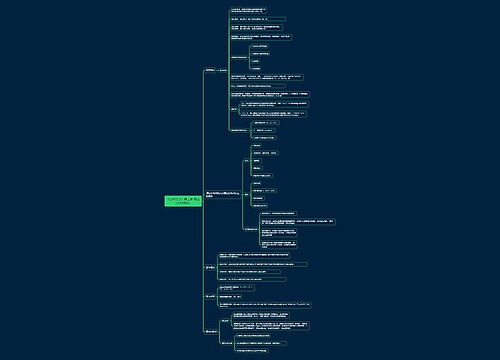
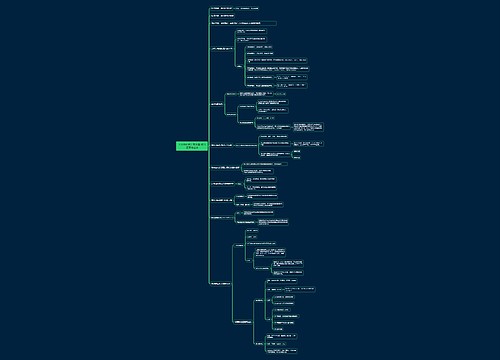
《分析化学》第十四章 核磁共振波谱法思维导图
 divlo_
divlo_树图思维导图提供《《分析化学》第十四章 核磁共振波谱法》在线思维导图免费制作,点击“编辑”按钮,可对《《分析化学》第十四章 核磁共振波谱法》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:30a2a9bee0d68ad655ade9793eab99e2