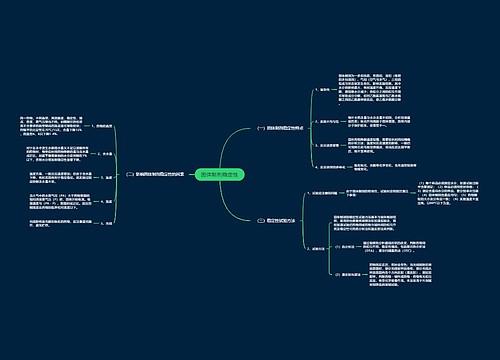
稳定性试验方法(1)思维导图
轻涟低眉
2023-02-21

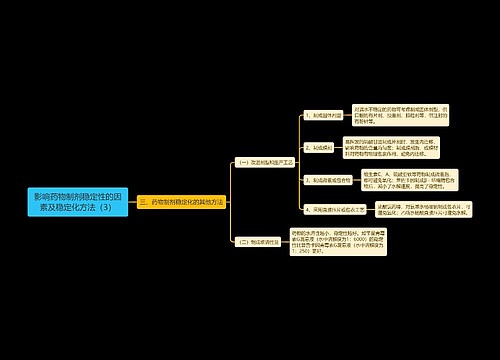
药物制剂稳定性研究是保证药品质量的重要手段,试验时必须遵循以下基本要求: (1)稳定性试验包括影响因素试验、加速试验与长期试验。
树图思维导图提供《稳定性试验方法(1)》在线思维导图免费制作,点击“编辑”按钮,可对《稳定性试验方法(1)》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:be4d9e901b2afea1eac2f2eb9c9e7722
思维导图大纲
相关思维导图模版
1113爆卡会总结会会议纪要思维导图
 U245265618
U245265618树图思维导图提供《1113爆卡会总结会会议纪要》在线思维导图免费制作,点击“编辑”按钮,可对《1113爆卡会总结会会议纪要》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:aaf6c152a765d5821e8e1787f2b3226e
第1章 化工设计基本知识思维导图
 U882667602
U882667602树图思维导图提供《第1章 化工设计基本知识》在线思维导图免费制作,点击“编辑”按钮,可对《第1章 化工设计基本知识》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:70ec0519ed26419068a32a511862aadd