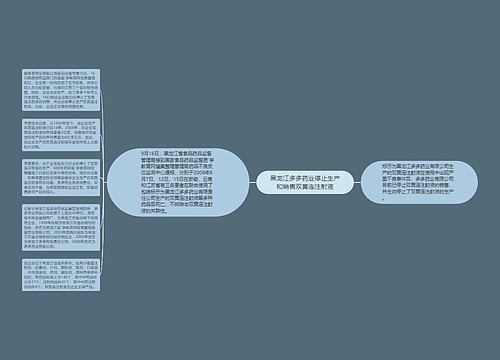
违规生产引发“欣弗”事件,暴露我国药品市场秩序混乱思维导图
草莓味的你
2023-02-21

2006年某日9时30分:开始注射“欣弗”克林霉素磷酸酯葡萄糖注射液;9时40分:身体出现四肢抖动、寒战、高烧、失语不良反应;10时40分:送至医院抢救,疑为克林霉素惹祸;12时05分:心脏停止跳动。这是一个患者注射“欣弗”后生命的最后155分钟。截至当日全国因注射"欣弗"出现不良反应的患者已有81人,其中3人死亡。
树图思维导图提供《违规生产引发“欣弗”事件,暴露我国药品市场秩序混乱》在线思维导图免费制作,点击“编辑”按钮,可对《违规生产引发“欣弗”事件,暴露我国药品市场秩序混乱》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:749f4065922215a5baed79c01bf367fb
思维导图大纲
相关思维导图模版
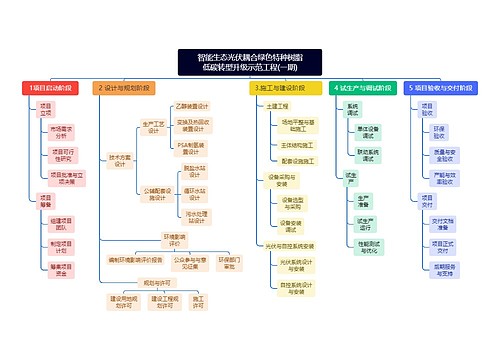
智能生态光伏耦合绿色特种树脂 低碳转型升级示范工程(一期)思维导图
 海蓝时见鲸
海蓝时见鲸树图思维导图提供《智能生态光伏耦合绿色特种树脂 低碳转型升级示范工程(一期)》在线思维导图免费制作,点击“编辑”按钮,可对《智能生态光伏耦合绿色特种树脂 低碳转型升级示范工程(一期)》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:11a7bbe63bdfb90059f74c1062891851
RBT工作管理计划思维导图
 U980720162
U980720162树图思维导图提供《RBT工作管理计划》在线思维导图免费制作,点击“编辑”按钮,可对《RBT工作管理计划》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:07511cf9c98d75f4a7a974d65f912b8f