进口药品分包装|注册思维导图
满身疲倦
2023-02-21

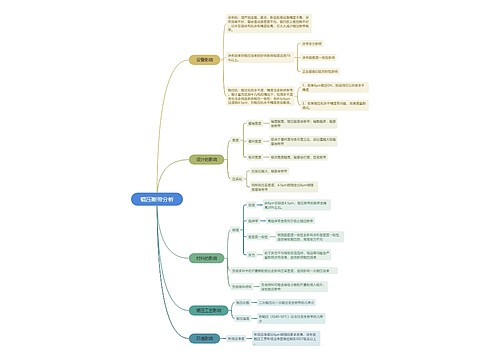
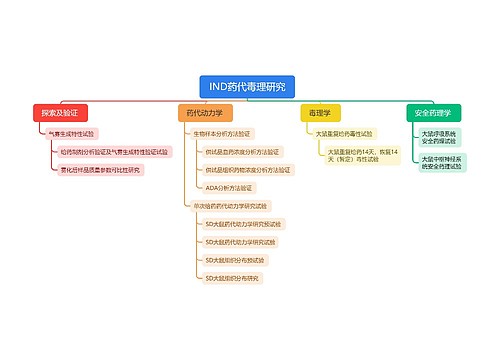
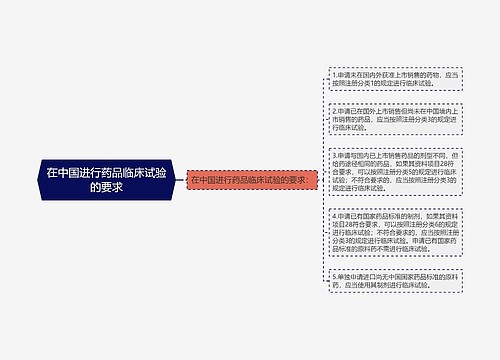
进口药品分包装|注册: 第九十六条 进口药品分包装,是指药品已在境外完成最终制剂生产过程,在境内由大包装规格改为小包装规格,或者对已完成内包装的药品进行外包装、放置说明书、粘贴标签等。
树图思维导图提供《进口药品分包装|注册》在线思维导图免费制作,点击“编辑”按钮,可对《进口药品分包装|注册》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:d5067f3bf2bce260a2b9a3d30ee6f93e
思维导图大纲
相关思维导图模版
904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查思维导图
 U633687664
U633687664树图思维导图提供《904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查》在线思维导图免费制作,点击“编辑”按钮,可对《904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:10b9a8a2dd2fb4593f8130ef16c320fc
辊压断带分析思维导图
 U678146910
U678146910树图思维导图提供《辊压断带分析》在线思维导图免费制作,点击“编辑”按钮,可对《辊压断带分析》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:55fdf0827fa2a220b0b4047d75df5032