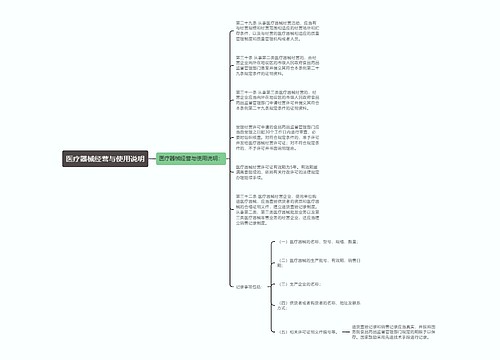
第四十六条 国家建立医疗器械不良事件监测制度,对医疗器械不良事件及时进行收集、分析、评价、控制。
第四十七条 医疗器械生产经营企业、使用单位应当对所生产经营或者使用的医疗器械开展不良事件监测;发现医疗器械不良事件或者可疑不良事件,应当按照国务院食品药品监督管理部门的规定,向医疗器械不良事件监测技术机构报告。任何单位和个人发现医疗器械不良事件或者可疑不良事件,有权向食品药品监督管理部门或者医疗器械不良事件监测技术机构报告。
第四十八条 国务院食品药品监督管理部门应当加强医疗器械不良事件监测信息网络建设。
医疗器械不良事件监测技术机构应当加强医疗器械不良事件信息监测,主动收集不良事件信息;发现不良事件或者接到不良事件报告的,应当及时进行核实、调查、分析,对不良事件进行评估,并向食品药品监督管理部门和卫生计生主管部门提出处理建议。
医疗器械不良事件监测技术机构应当公布联系方式,方便医疗器械生产经营企业、使用单位等报告医疗器械不良事件。
第四十九条 食品药品监督管理部门应当根据医疗器械不良事件评估结果及时采取发布警示信息以及责令暂停生产、销售、进口和使用等控制措施。
第五十条 医疗器械生产经营企业、使用单位应当对医疗器械不良事件监测技术机构、食品药品监督管理部门开展的医疗器械不良事件调查予以配合。
第五十一条 有下列情形之一的,省级以上人民政府食品药品监督管理部门应当对已注册的医疗器械组织开展再评价:
(一)根据科学研究的发展,对医疗器械的安全、有效有认识上的改变的;
(二)医疗器械不良事件监测、评估结果表明医疗器械可能存在缺陷的;
(三)国务院食品药品监督管理部门规定的其他需要进行再评价的情形。
再评价结果表明已注册的医疗器械不能保证安全、有效的,由原发证部门注销医疗器械注册证,并向社会公布。被注销医疗器械注册证的医疗器械不得生产、进口、经营、使用。
第五十二条 医疗器械生产企业发现其生产的医疗器械不符合强制性标准、经注册或者备案的产品技术要求或者存在其他缺陷的,应当立即停止生产,通知相关生产经营企业、使用单位和消费者停止经营和使用,召回已经上市销售的医疗器械,采取补救、销毁等措施,记录相关情况,发布相关信息,并将医疗器械召回和处理情况向食品药品监督管理部门和卫生计生主管部门报告。
医疗器械经营企业发现其经营的医疗器械存在前款规定情形的,应当立即停止经营,通知相关生产经营企业、使用单位、消费者,并记录停止经营和通知情况。医疗器械生产企业认为属于依照前款规定需要召回的医疗器械,应当立即召回。
医疗器械生产经营企业未依照本条规定实施召回或者停止经营的,食品药品监督管理部门可以责令其召回或者停止经营。

 U382203073
U382203073
 U882044555
U882044555