IL-12分泌的肿瘤靶向性T细胞与癌症的过继免疫治疗思维导图
没顾忌
2023-02-17

在基因水平上,T细胞修饰肿瘤细胞上的靶抗原是通过编码CAR的基因的逆转录病毒的插入调节的。通常CAR是由鼠科抗体来源的肿瘤靶向单链片段长度抗体(scFv)组成的。该抗体融合CD28共刺激受体跨膜区和胞质域信号区,融合到CD36胞质域信号区。T细胞表达的CAR基因产物随后识别和裂解表达靶抗原的正常细胞和肿瘤胞。
树图思维导图提供《IL-12分泌的肿瘤靶向性T细胞与癌症的过继免疫治疗》在线思维导图免费制作,点击“编辑”按钮,可对《IL-12分泌的肿瘤靶向性T细胞与癌症的过继免疫治疗》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:23c3676e0633e88dec9474f118e8af4b
思维导图大纲
相关思维导图模版
904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查思维导图
 U633687664
U633687664树图思维导图提供《904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查》在线思维导图免费制作,点击“编辑”按钮,可对《904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:10b9a8a2dd2fb4593f8130ef16c320fc

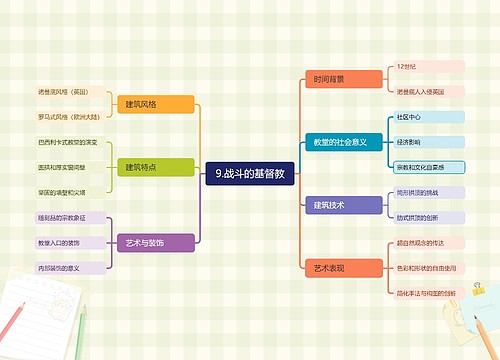
9.战斗的基督教思维导图
 U582679646
U582679646树图思维导图提供《9.战斗的基督教》在线思维导图免费制作,点击“编辑”按钮,可对《9.战斗的基督教》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:33d168acd0cd9f767f809c7a5df86e3a