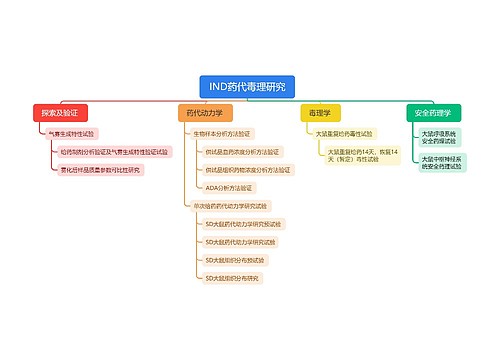
羟乙基淀粉禁用于危重疾病和心肺转流术患者思维导图
蓝胖子
2023-02-17

近日,美国食品药品管理局(FDA)发布警告指出,羟乙基淀粉(HES)溶液不应再用于危重疾病成年患者的治疗,包括脓毒症患者和重症监护病房(ICU) 入住患者。这是FDA在对有关HES溶液可能增加上述患者死亡和肾脏损害风险的数据进行分析后发出的警告。
树图思维导图提供《羟乙基淀粉禁用于危重疾病和心肺转流术患者》在线思维导图免费制作,点击“编辑”按钮,可对《羟乙基淀粉禁用于危重疾病和心肺转流术患者》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:3f73ce83aac1e28f7b31e81e24c4c638
思维导图大纲
相关思维导图模版
904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查思维导图
 U633687664
U633687664树图思维导图提供《904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查》在线思维导图免费制作,点击“编辑”按钮,可对《904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:10b9a8a2dd2fb4593f8130ef16c320fc
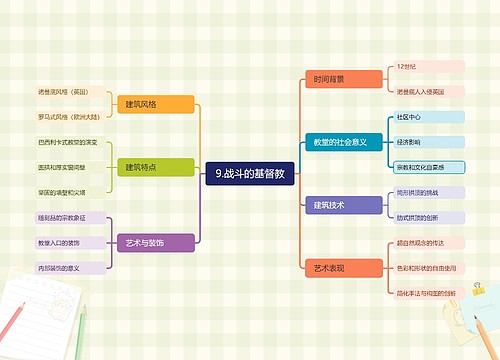
9.战斗的基督教思维导图
 U582679646
U582679646树图思维导图提供《9.战斗的基督教》在线思维导图免费制作,点击“编辑”按钮,可对《9.战斗的基督教》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:33d168acd0cd9f767f809c7a5df86e3a