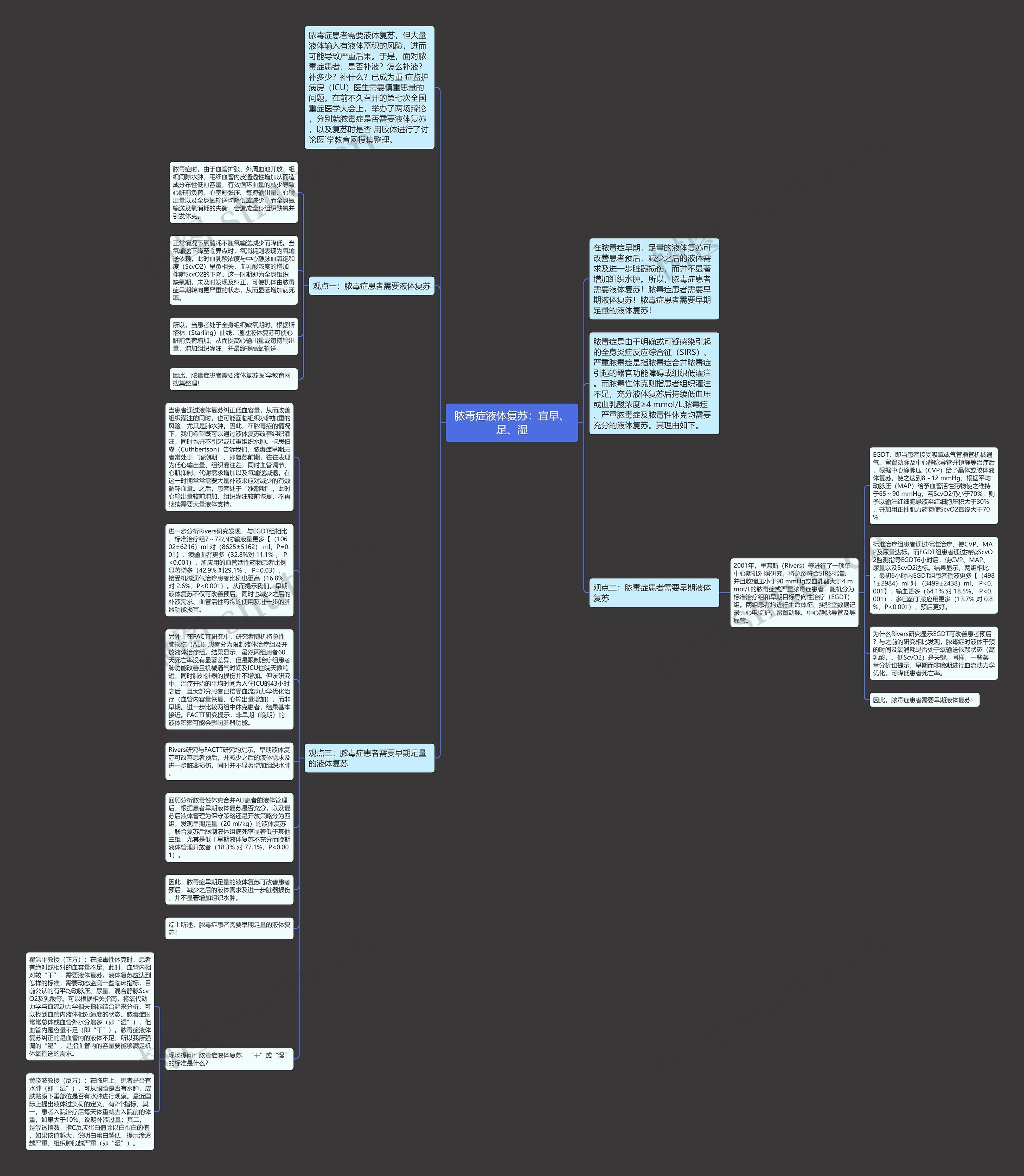
当患者通过液体复苏纠正低血容量,从而改善组织灌注的同时,也可能面临组织水肿加重的风险,尤其是肺水肿。因此,在脓毒症的情况下,我们希望既可以通过液体复苏改善组织灌注,同时也并不引起或加重组织水肿。卡思伯森(Cuthbertson)告诉我们,脓毒症早期患者常处于“落潮期”,即复苏前期,往往表现为低心输出量、组织灌注差,同时血管调节、心肌抑制、代谢需求增加以及氧输送减退。在这一时期常常需要大量补液来应对减少的有效循环血量。之后,患者处于“涨潮期”,此时心输出量较前增加、组织灌注较前恢复,不再继续需要大量液体支持。
进一步分析Rivers研究发现,与EGDT组相比,标准治疗组7~72小时输液量更多【(10602±6216)ml 对(8625±5162) ml,P=0.01】,须输血者更多(32.8%对 11.1% , P<0.001),所应用的血管活性药物患者比例显著增多(42.9% 对29.1% , P=0.03),接受机械通气治疗患者比例也更高(16.8% 对 2.6%,P<0.001)。从而提示我们,早期液体复苏不仅可改善预后,同时也减少之后的补液需求、血管活性药物的使用及进一步的脏器功能损害。
另外,在FACTT研究中,研究者随机将急性肺损伤(ALI)患者分为限制液体治疗组及开放液体治疗组。结果显示,虽然两组患者60天死亡率没有显著差异,但是限制治疗组患者肺功能改善且机械通气时间及ICU住院天数缩短,同时肺外脏器的损伤并不增加。但该研究中,治疗开始的平均时间为入住ICU的43小时之后,且大部分患者已接受血流动力学优化治疗(血管内容量恢复、心输出量增加),而非早期。进一步比较两组中休克患者,结果基本接近。FACTT研究提示,非早期(晚期)的液体积聚可能会影响脏器功能。
Rivers研究与FACTT研究均提示,早期液体复苏可改善患者预后,并减少之后的液体需求及进一步脏器损伤,同时并不显著增加组织水肿。
回顾分析脓毒性休克合并ALI患者的液体管理后,根据患者早期液体复苏是否充分,以及复苏后液体管理为保守策略还是开放策略分为四组,发现早期足量(20 ml/kg)的液体复苏,联合复苏后限制液体组病死率显著低于其他三组,尤其是低于早期液体复苏不充分而晚期液体管理开放者(18.3% 对 77.1%,P<0.001)。
因此,脓毒症早期足量的液体复苏可改善患者预后,减少之后的液体需求及进一步脏器损伤,并不显著增加组织水肿。
现场提问:脓毒症液体复苏,“干”或“湿”的标准是什么?
瞿洪平教授(正方):在脓毒性休克时,患者有绝对或相对的血容量不足,此时,血管内相对较“干”,需要液体复苏。液体复苏应达到怎样的标准,需要动态监测一些临床指标,目前公认的有平均动脉压、尿量、混合静脉ScvO2及乳酸等。可以根据相关指南,将氧代动力学与血流动力学相关指标结合起来分析,可以找到血管内液体相对适度的状态。脓毒症时常常总体或血管外水分增多(即“湿”),但血管内是容量不足(即“干”)。脓毒症液体复苏纠正的是血管内的液体不足,所以我所强调的“湿”,是指血管内的容量要能够满足机体氧输送的需求。
黄晓波教授(反方):在临床上,患者是否有水肿(即“湿”),可从眼睑是否有水肿,皮肤黏膜下垂部位是否有水肿进行观察。最近国际上提出液体过负荷的定义,有2个指标,其一,患者入院治疗后每天体重减去入院前的体重,如果大于10%,说明补液过量;其二,是渗透指数,指C反应蛋白值除以白蛋白的值,如果该值越大,说明白蛋白越低,提示渗透越严重,组织肿胀越严重(即“湿”)。
 U381450064
U381450064
 U580630777
U580630777