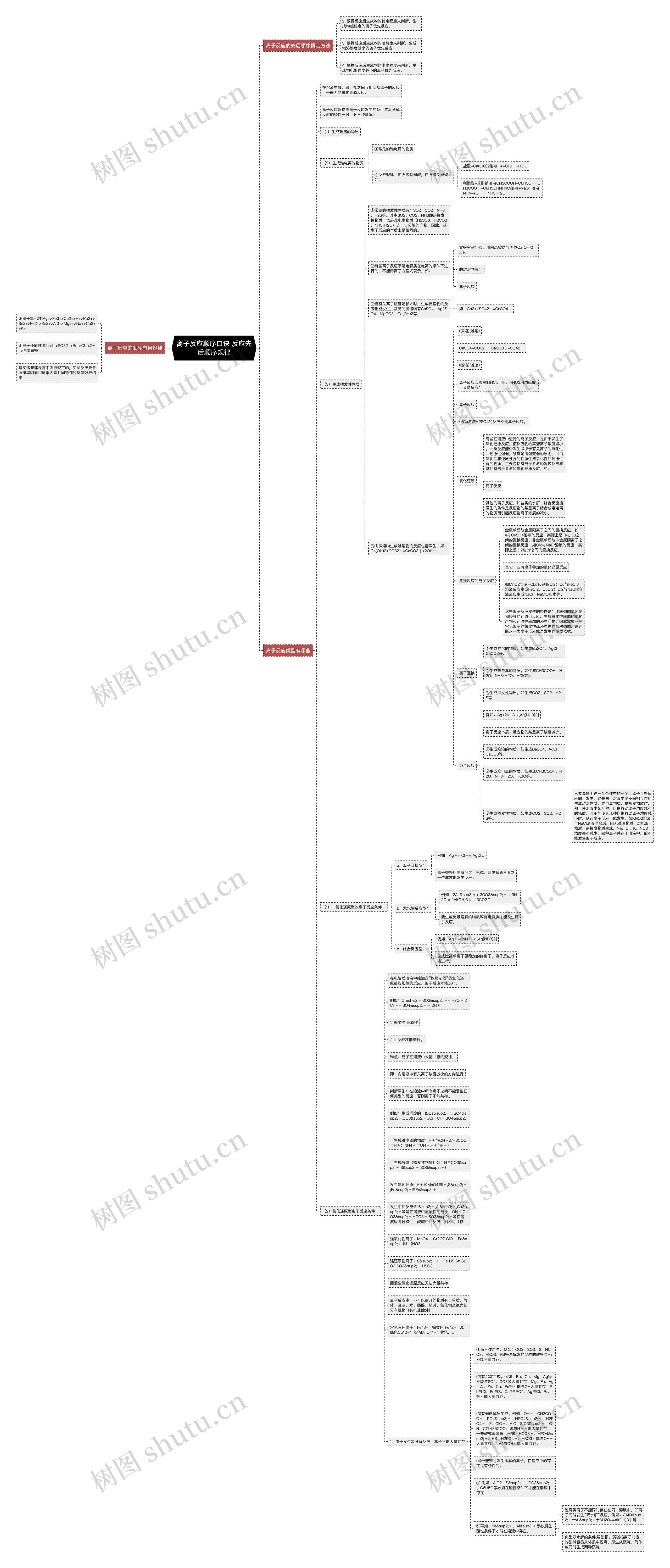
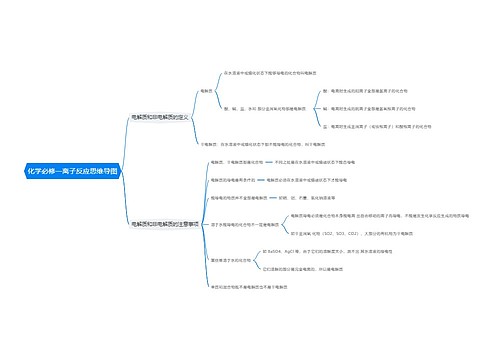
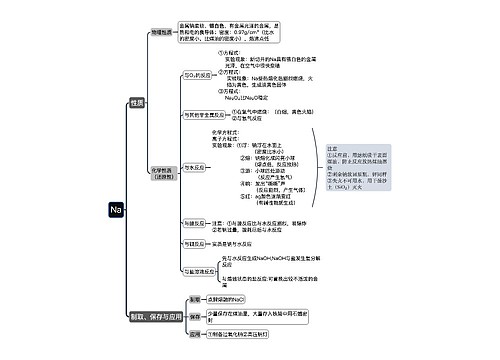
在电解质溶液中能满足“以强制弱”的氧化还原反应规律的反应,离子反应才能进行。
例如:Cl­2 + SO3² ﹣+ H2O = 2Cl ﹣+ SO4²﹣ + 2H﹢
判断原则:在溶液中所有离子之间不能发生任何类型的反应,否则离子不能共存。
例如:生成沉淀的:如Ba²﹢与SO4²﹣,CO3²﹣;Ag与Cl﹣,SO4²﹣
(生成难电离的物质:H﹢与OH﹣;CH3COO与H﹢;NH4﹢与OH﹣;H﹢与F﹣)
(生成气体(挥发性物质)如:H与CO3²﹣,S²﹣,SO3²﹣)
发生氧化还原: (H﹢)KMnO4与I﹣,S²﹣;Fe²﹢与Fe³﹢
发生中和反应:Fe²﹢,Al³﹢,Cu²﹢等是在溶液中显酸性的离子,OH﹣,CO3²﹣,HCO3﹣,SO3²﹣等在溶液里则显碱性,酸碱中和反应,则不可共存
强氧化性离子:MnO4﹣ Cr2O7 ClO﹣ Fe²﹢ (H﹢)NO3﹣
强还原性离子:S²﹣ I﹣ Fe HS Sn S2O3 SO3²﹣ HSO3﹣
离子反应中,不可以拆开的物质有:单质、气体、沉淀、水、弱酸、弱碱、氧化物及绝大部分有机物(有机盐除外)
常见有色离子:Fe^3+:棕黄色 Fe^2+:浅绿色Cu^2+:蓝色MnO4^-:紫色……
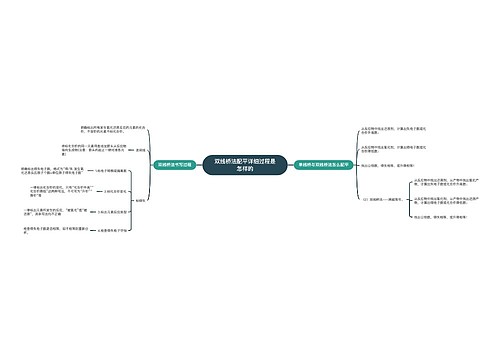
1.由于发生复分解反应,离子不能大量共存
(1)有气体产生。例如:CO3、SO3、S、HCO3、HSO3、HS等易挥发的弱酸的酸根与H+不能大量共存。
(2)有沉淀生成。例如:Ba、Ca、Mg、Ag等不能与SO4、CO3等大量共存;Mg、Fe、Ag、Al、Zn、Cu、Fe等不能与OH大量共存;Pb与Cl,Fe与S、Ca2与PO4、Ag与Cl、Br、I等不能大量共存。
(3)有弱电解质生成。例如:OH﹣、CH3COO﹣、PO4³﹣、HPO4²﹣、H2PO4﹣、F、ClO﹣、AlO、SiO3²﹣、CN、C17H35COO、等与H﹢不能大量共存;一些酸式弱酸根,例如:HCO3﹣、HPO4²﹣、HS、H2PO4﹣、HSO3不能与OH﹣大量共存;NH4与OH不能大量共存。
(4)一些容易发生水解的离子,在溶液中的存在是有条件的:
① 例如:AlO2、S²﹣、CO3²﹣、C6H5O等必须在碱性条件下才能在溶液中存在;
②再如:Fe²﹢、Al³﹢等必须在酸性条件下才能在溶液中存在。
这两类离子不能同时存在在同一溶液中,即离子间能发生“双水解”反应。例如:3AlO²﹣十Al³﹢十6H2O=4Al(OH)3↓等
典型双水解的条件;弱酸根、弱碱根离子对应的酸碱容易从体系中脱离。即生成沉淀、气体或同时生成两种沉淀