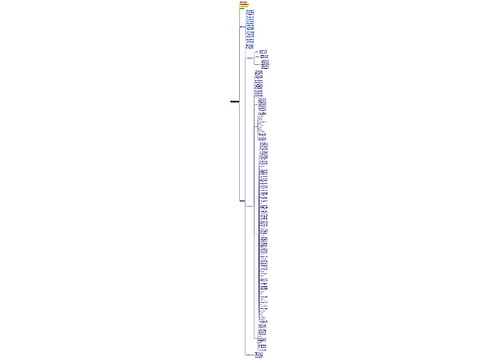
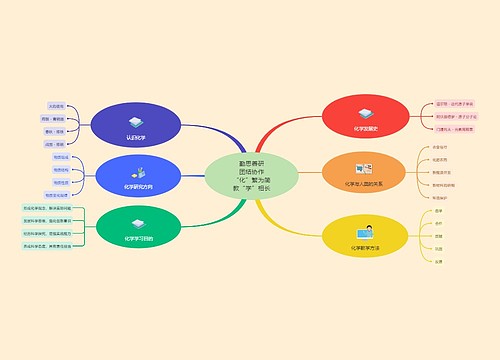
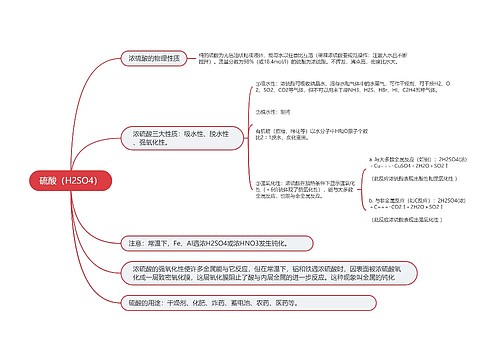
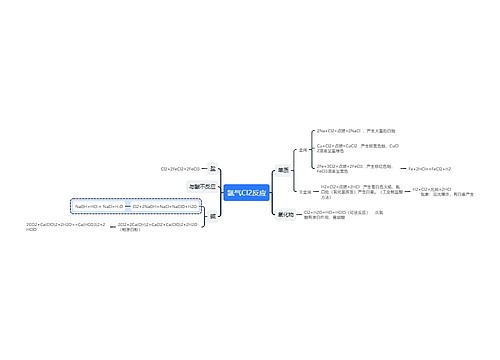
高三化学重要知识点总结思维导图
叹黄昏
2022-12-23
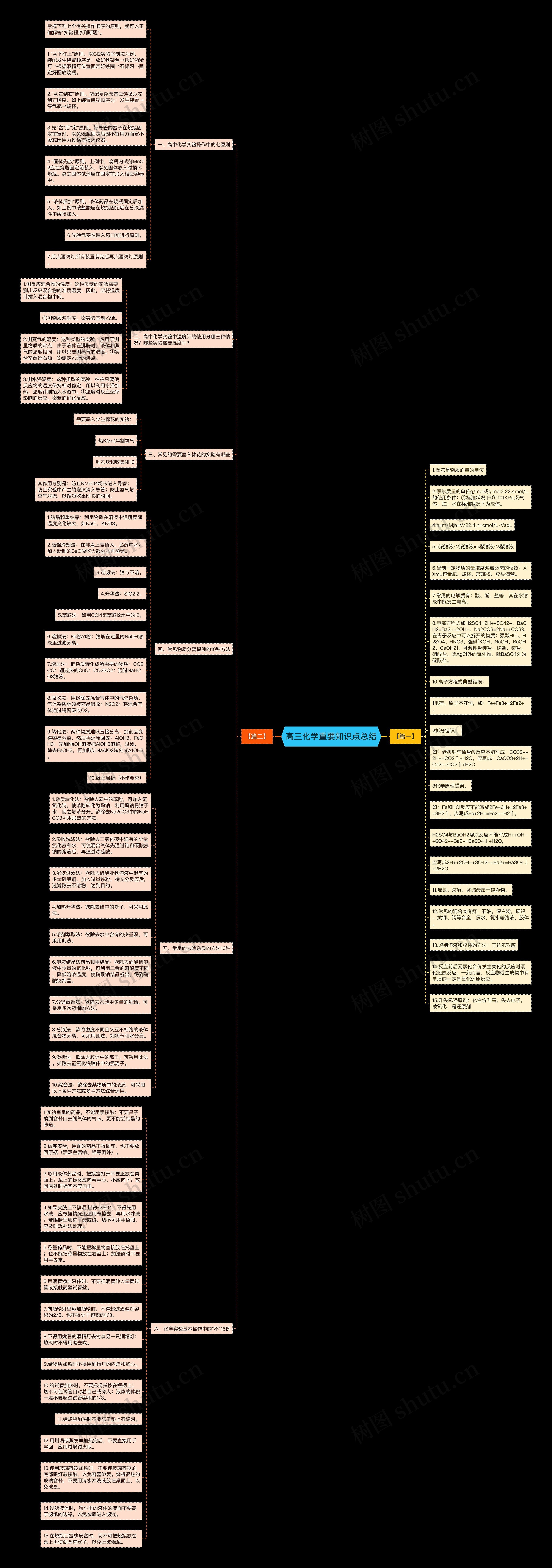
高三学生很快就会面临继续学业或事业的选择。面对重要的人生选择,是否考虑清楚了?这对于没有社会经验的学生来说,无疑是个困难的想选择。如何度过这重要又紧张的一年,我们可以从提高学习效率来着手!树图网高三频道为各位同学整理了《高三化学重要知识点总结》,希望你努力学习,圆金色六月梦!
树图思维导图提供《高三化学重要知识点总结》在线思维导图免费制作,点击“编辑”按钮,可对《高三化学重要知识点总结》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:cc0a6c66227d5eeee68be96a183b0ea3
思维导图大纲
相关思维导图模版
1113爆卡会总结会会议纪要思维导图
 U245265618
U245265618树图思维导图提供《1113爆卡会总结会会议纪要》在线思维导图免费制作,点击“编辑”按钮,可对《1113爆卡会总结会会议纪要》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:aaf6c152a765d5821e8e1787f2b3226e
第1章 化工设计基本知识思维导图
 U882667602
U882667602树图思维导图提供《第1章 化工设计基本知识》在线思维导图免费制作,点击“编辑”按钮,可对《第1章 化工设计基本知识》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:70ec0519ed26419068a32a511862aadd