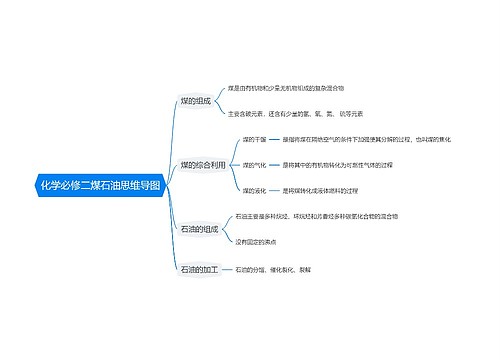
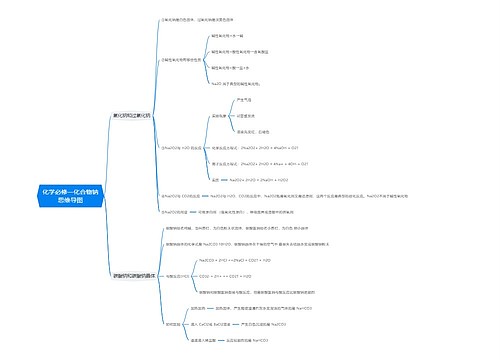
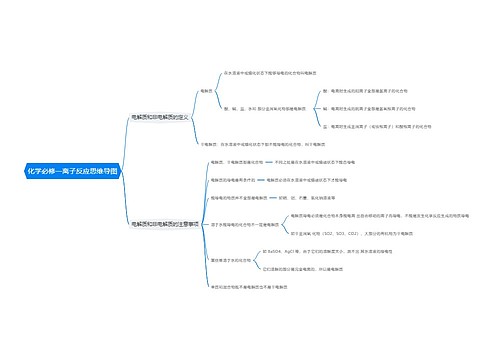
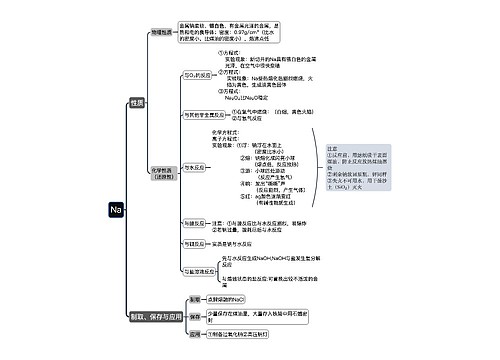
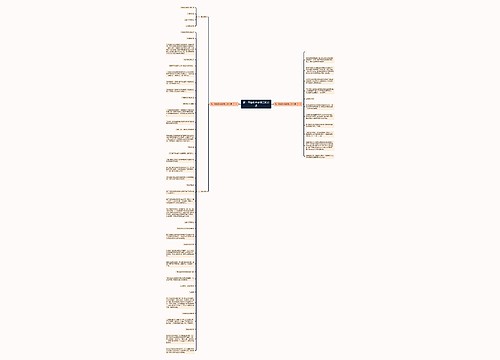
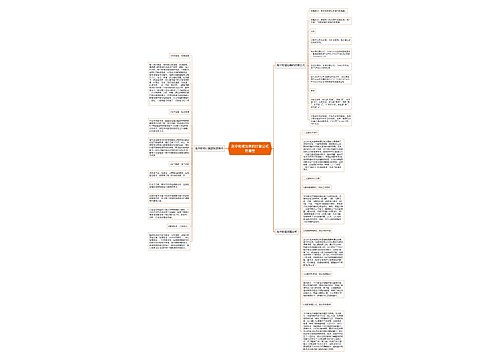
人教版高一化学必修三知识点思维导图
心不动则不痛
2022-12-21
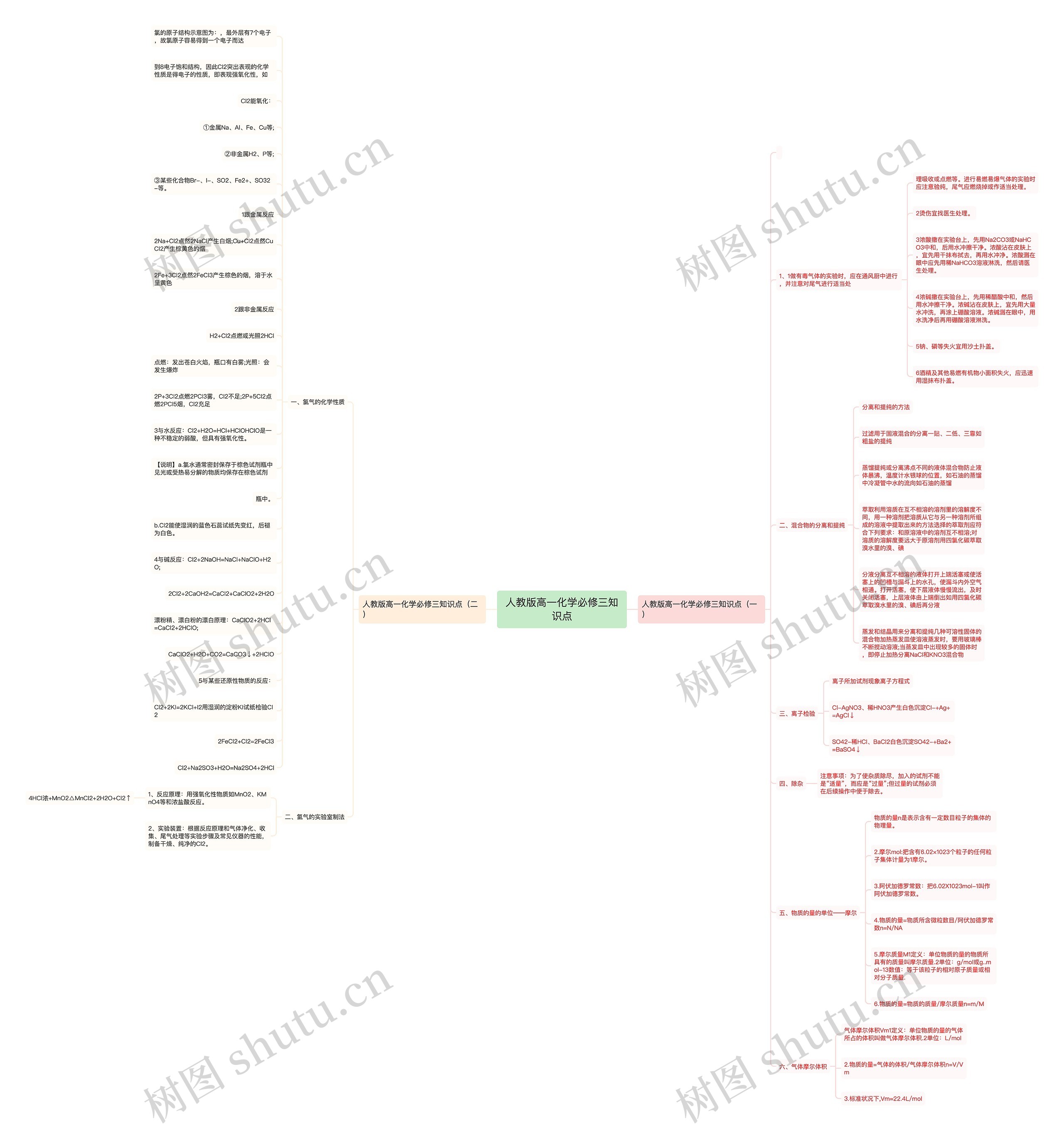
进入高中后,很多新生有这样的心理落差,比自己成绩优秀的大有人在,很少有人注意到自己的存在,心理因此失衡,这是正常心理,但是应尽快进入学习状态。树图网高一频道为正在努力学习的你整理了《人教版高一化学必修三知识点》,希望对你有帮助!
树图思维导图提供《人教版高一化学必修三知识点》在线思维导图免费制作,点击“编辑”按钮,可对《人教版高一化学必修三知识点》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:965f418bd8c6779794538e2e135d3dfe
思维导图大纲
相关思维导图模版
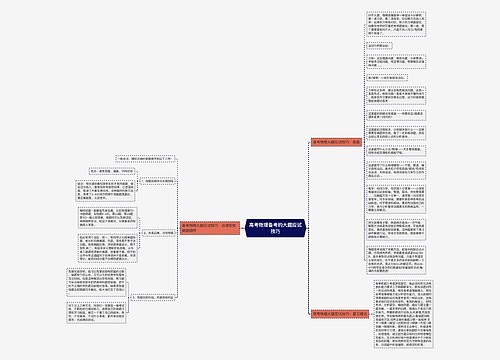
人教版必修一:分子与细胞思维导图
 U577994578
U577994578树图思维导图提供《人教版必修一:分子与细胞》在线思维导图免费制作,点击“编辑”按钮,可对《人教版必修一:分子与细胞》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:38b99f99a660f9eb846aafd51549cc03
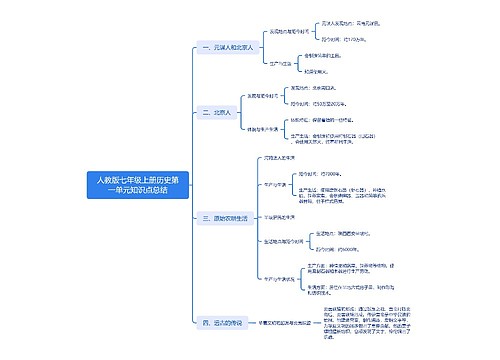
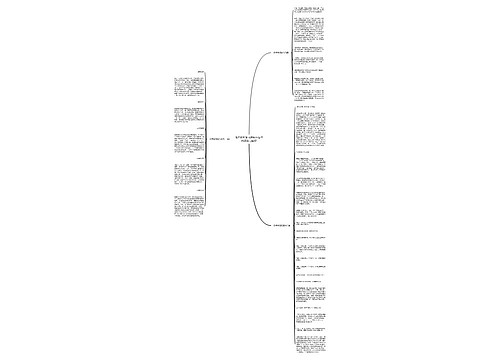
人教版七年级上册历史第一单元知识点总结思维导图
 U280479982
U280479982树图思维导图提供《人教版七年级上册历史第一单元知识点总结》在线思维导图免费制作,点击“编辑”按钮,可对《人教版七年级上册历史第一单元知识点总结》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:36f34ea5719d2b951763c087ab2170c3