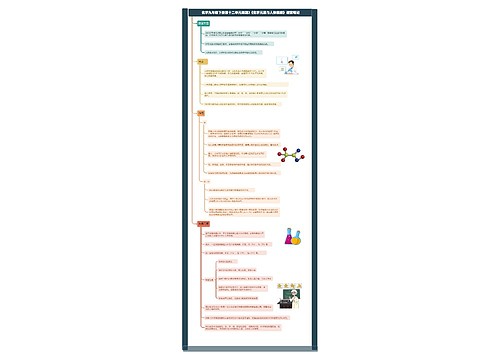
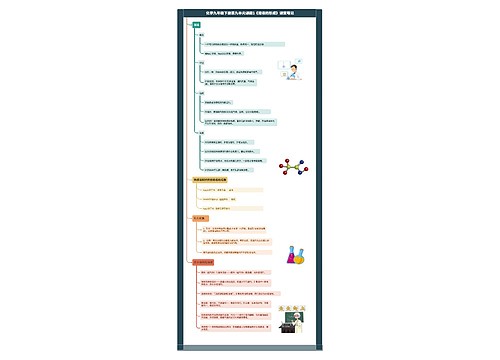
化学九年级下册第八单元课题3《金属资源的利用和保护》课堂笔记思维导图
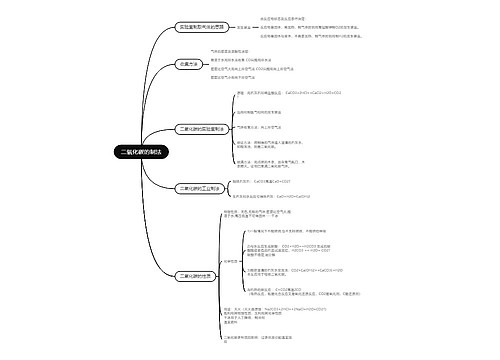
二硫碘化钾
2023-04-30

讲述了化学九年级下册第八单元课题3《金属资源的利用和保护》课堂笔记
树图思维导图提供《化学九年级下册第八单元课题3《金属资源的利用和保护》课堂笔记》在线思维导图免费制作,点击“编辑”按钮,可对《化学九年级下册第八单元课题3《金属资源的利用和保护》课堂笔记》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:1e618bff71b1c93de23822c5ee621a28
思维导图大纲
相关思维导图模版
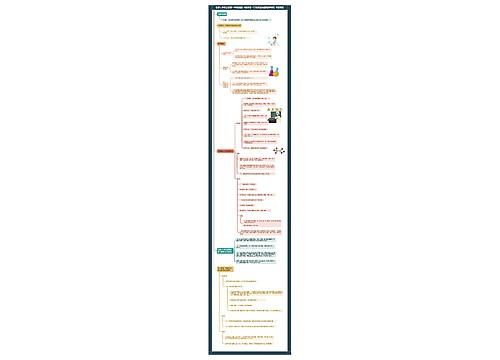
化学九年级下册第十二单元课题3《有机合成材料》课堂笔记思维导图
树图思维导图提供《化学九年级下册第十二单元课题3《有机合成材料》课堂笔记》在线思维导图免费制作,点击“编辑”按钮,可对《化学九年级下册第十二单元课题3《有机合成材料》课堂笔记》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:17425c74f11dcdc021c8cad04d5a8daa

化学九年级下册第十二单元课题2《化学元素与人体健康》课堂笔记思维导图
树图思维导图提供《化学九年级下册第十二单元课题2《化学元素与人体健康》课堂笔记》在线思维导图免费制作,点击“编辑”按钮,可对《化学九年级下册第十二单元课题2《化学元素与人体健康》课堂笔记》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:9ab4f89f1b414008363dafb59a780934