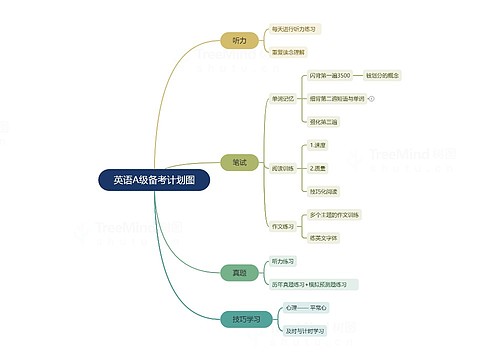
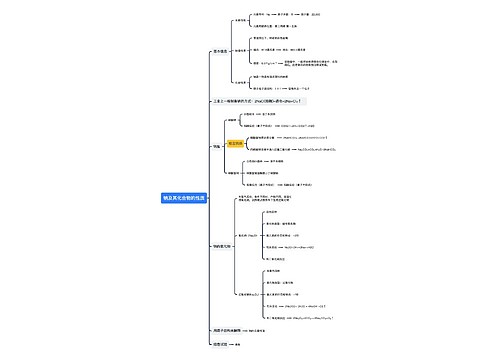
1.使学生了解元素周期表的结构以及周期、族等概念。
2.通过对元素周期律的发现及元素周期表的编制过程的了解,使学生正确认识科学发展的历程,并以此来引导自己的实践,同时促使他们逐渐形成为科学献身的高贵品质。
3.使学生了解元素周期律和周期表的意义,认识事物变化由量变引起质变的规律,对他们进行辩证唯物主义教育。
[引言]上一节我们学习了元素周期律,知道元素的性质随着原子序数的递增而呈现周期性的变化。那么,有没有一种工具可以把我们已知的一百多种元素之间的这种周期性很好地表现出来呢?答案是肯定的。那就是元素周期表,也是我们本节课所要讲的主要内容。
[师]元素周期表是元素周期律的具体表现形式,它反映了元素之间相互联系的规律,是我们学习化学的重要工具,下面,我们就来学习元素周期表的有关知识。
[师]元素周期表有不同的形式,我们这里介绍的是一种最常见的形式。它的编排原则如下:
3.把最外层电子数相同(严格地说是外围电子排布相似)的元素按电子层递增的顺序从上到下排成纵行。
[师]按以上原则对元素进行排列便得到我们所看到的这种元素周期表。
[师]我们把元素周期表中的每一个横行称作一个周期,每一个纵行或几个纵行称作一族。
下面,我们先来认识一下元素周期表中的横行——周期。
[师]元素周期表中有7个横行,故有7个周期,从上到下分别用1、2、3、4、5、6、7标记,我们把其称为周期序数。
请大家回忆1~18号元素原于结构示意图,分析元素的周期序数与元素原子的电子层数有什么关系。
[学生分析思考后回答] 元素的周期序数等于元素原子的电子层数。
[师]元素周期表中,我们把1、2、3周期称为短周期,4、5、6周期称为长周期,第7周期称为不完全周期,因为一直有未知元素在被发现。
[师]从上面我们所填表的结果可知,在元素周期表的7个周期中,除第1周期只包括氢和氦,第7周期尚未填满外,每一周期的元素都是从最外层电子数为1的碱金属开始,逐步过渡到最外层电子数为7的卤素,最后以最外层电子数为8的稀有气体结束。
需作说明的是:第6周期中,57号元素镧(La)到71号元素镥(Lu),共15种元素,它们原子的电子层结构和性质十分相似,总称镧系元素。第7周期中,89号元素锕(Ac)到103号元素铹(Lr),共15种元素,它们原子的电子层结构和性质也十分相似,总称锕系元素。为了使表的结构紧凑,将全体镧系元素和锕系元素分别按周期各放在同一个格内,并按原子序数递增的顺序,把它们分两行另列在表的下方。在锕系元素中92号元素铀(U)以后的各种元素,多数是人工进行核反应制得的元素,这些元素又叫做超铀元素。
元素周期表上列出来的元素共有112种,而事实上现在发现的元素还有:114号、116号、118号元素。
[过渡]学完了元素周期表中的横行——周期,我们再来认识元素周期表中的纵行——族。
[师]请大家数一下,周期表中共有多少个纵行? 18个
[师]在每一个纵行的上面,分别有罗马数字Ⅰ、Ⅱ、……及A、B、0等字样,它们分别表示什么意思呢?
[师]A、B又分别表示什么呢? A表示主族,B表示副族
由短周期元素和长周期元素共同构成的族,叫做主族:完全由长周期元素构成的族,叫做副族。
[师]元素周期表中共有多少个主族?多少个副族? 7个主族,7个副族
[师]元素周期表中还有哪些纵行没提到? 零族和第Ⅷ族
[师]零族元素都是什么种类的元素?为什么把它们叫零族?。
零族元素均为稀有气体元素。由于它们的化学性质非常不活泼,在通常状况下难以与其他物质发生化学反应,把它们的化合价看作为零,因而叫做零族。
[师]分析元素周期表中从ⅢB到ⅡB之间的元素名称,它们的偏旁部首有什么特点?说明什么?
[师]元素周期表的中部从ⅢB族到ⅡB族10个纵行,包括了第Ⅷ族和全部副族元素,共六十多种元素,通称为过渡元素。因为这些元素都是金属,所以又把它们叫做过渡金属。
[师]请大家根据本节的学习内容,填写板书中的空白。
[师][指住板书内容]此即为元素周期表的主要结构。在中学化学里,我们主要学习主族元素的性质。
[师]元素的性质主要是由元素原子的最外层电子数决定的。请大家分析讨论主族元素的族序数与主族元素原子的最外层电子数有什么关系?可参考我们学习过的碱金属、卤族元素以及1~20元素原子的结构示意图。
[学生分析、讨论] 主族元素的族序数等于其最外层电子数
[讲述并板书] 主族元素的族序数 = 元素原子的最外层电子数
[投影练习]已知某主族元素的原子结构示意图如下,判断其位于第几周期,第几族?
X位于第四周期、第一主族;Y位于第五周期、第七主族。
[师]能判断它们分别是什么元素吗?可对照元素周期表。 X为钾元素,Y为碘元素。
[师]下面根据本节周期和族的知识,并结合元素原子核外电子排布规律的知识完成练习。
A.一定是8个 B.一定是2个 C.一定是18个 D.是2个、8个或18个
2.若某ⅡB族元素原子序数为x,那么原子序数为x+1的元素位于………………( B )
3.已知A元素原子的最外层电子数是次外层电子数的3倍,B元素原子的次外层电子数是最外层电子数的2倍,则A、B元素……………………………………………( CD )
C.可能是二、三周期元素 D.可以相互化合形成化合物
[过渡]以上,我们了解了元素周期表的结构。那么,科学家们在完成这张元素周期表时,经历了怎样的一个过程呢?请大家阅读课本P107《元素周期律的发现》这部分内容,并思考以下问题。
2.元素周期律的发现和周期表的编制是否应完全归功于门捷列夫?
3.门捷列夫总结出的元素周期律是否就是我们现在所学的元素周期律?
4.门捷列夫在研究的过程中,最突出的两大功绩是什么?
5.通过这些资料,你认为人类认识世界的过程是不是一帆风顺的?所得到的知识是否都

 U882044555
U882044555
 斯内普的洗发水
斯内普的洗发水