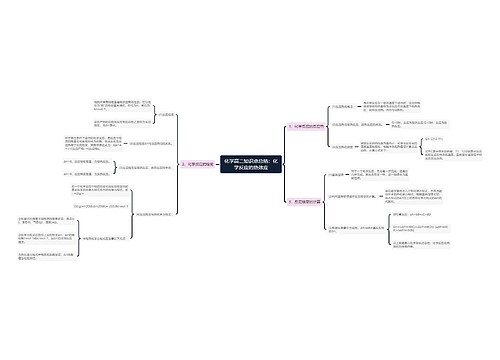
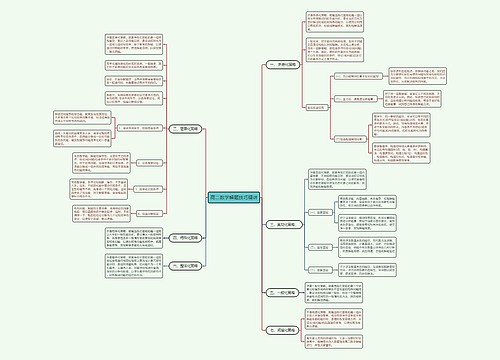
1某温度下,某一固定容器中进行的aA(g)+bB(g) = cC(g) 的可逆反应,若某气体的体积分数不变,则该反应一定达到了化学反应的限度即化学平衡状态吗?
经常在题目中看到当某气体的体积分数不变时,即认定化学反应达到了化学平衡,这种说法其实是一种误解。一定条件下,当反应物和生成物浓度不变时,可逆反应达到了化学平衡状态,但是某气体的体积分数不变并不能推出各物质的浓度不变。例如某温度下,某一固定体积为1L的密闭容器,充入1mol N2和1molH2发生合成氨反应,则有
////////////////////////////////////////////////////////N2(g)+3H2(g)=2NH3
任意时刻转化了的物质的量(mol) x 3x 2x
任意时刻的物质的量(mol) 1-x 1-3x 2x
由此N2的初始体积分数为50%,任意时刻N2的体积分数为(1-x)/(1-x+1-3x+2x)*100%=50%。
因此单独的指明某一气体的体积分数不变并不能说明反应达到了平衡状态,只有说明各气体的体积分数均不变才能说明该反应达到了化学平衡状态。同理对于上述密闭体系的合成氨反应,升高温度,平衡尽管逆向移动,但是N2的体积分数不变。
勒夏特列原理,几乎能适用所有的化学平衡移动问题,但并不是全部的化学平衡移动问题。我们要认识到勒夏特列原理不是在所有条件下都成立的,我们不能用勒夏特列原理解释所有的化学平衡移动的问题:勒夏特列原理仅仅适用于封闭、均相体系,只能在改变影响化学平衡的一个条件时适用。并且对于某些复杂反应,大多数反应为非基元反应,连质量作用定律都不能服从,其平衡常数的表达式也不能简单写出,要由实验获得,此时,定性的勒夏特列原理显然不能解决这些复杂的化学平衡移动问题。现在很多教材都开始淡化勒夏特列原理,而是采用更一般的平衡移动原理,引入反应商数和范特霍夫定律结合化学平衡常数定量解决平衡移动的方向问题,最后介绍定性的勒夏特列原理进行补充。
3一定条件下,平衡移动的结果只能减弱这种改变,不能完全抵消这种改变吗?
勒夏特列原理指出:改变影响化学平衡的一个因素,平衡将向着能够减弱这种改变的方向移动。很多人由此认为平衡移动的结果只能减弱这种改变,不能完全抵消这种改变,这是对勒夏特列原理的误解,勒夏特列原理仅仅指出平衡移动的方向,没有指出平衡移动的结果。例如一定温度下某密闭容器中进行碳酸钙的分解反应,达到化学平衡后,保持温度不变,缩小容器体积,平衡逆移,但是最终c(CO2)不变,压强不变。因为温度不变,化学平衡常数K不变,而平衡常数的表达式为K=c(CO2)。因此使用勒夏特列原理一定要注意其适用范围。
4 达到化学平衡状态时,反应物和生成物一定同时存在吗?
化学平衡研究的对象为可逆反应,一般情况下可逆反应达到化学平衡时,反应物和生成物共存,但是对于某些非均相反应,例如某温度下的密闭体系中碳酸钙分解的反应,达到平衡后,全部移走固体碳酸钙或者氧化钙,平衡不移动即仍为化学平衡状态,可见当全部移走碳酸钙时仍为平衡状态,但此时仅存在生成物。

 U249128194
U249128194
 U882178619
U882178619