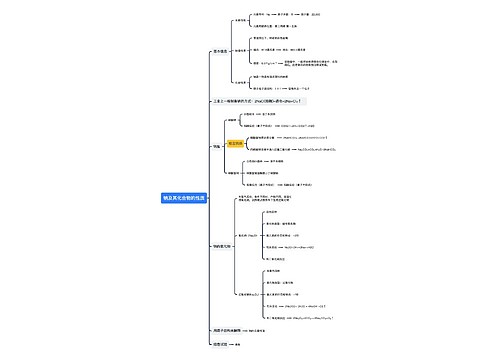
5、描述下列实验现象:(1)铜丝在氯气中燃烧(2)H2在Cl2中燃烧(3)CH4与Cl2混合光照(1)产生棕黄色的烟(2)产生苍白色的火焰(3)黄绿色变浅,瓶内壁有油状液滴
7、检验Cl-先加稀HNO3酸化,再加入AgNO3溶液,有白色沉淀
2、能使品红褪色的气体SO2(颜色可复现)、Cl2(颜色不可复现)
6、检验SO先加稀盐酸酸化,再加入BaCl2溶液,有白色沉淀
7、某溶液加入盐酸产生刺激气味气体,该溶液中定含有:SO32-
1、常用作金属焊接保护气、代替稀有气体填充灯泡、保存粮食水果的气体N2
4、有颜色的气体Cl2(黄绿色)、NO2(红棕色)、
12、某溶液加入NaOH溶液产生气体气体一定是NH3;溶液一定含NH
13、检验某白色固体是铵盐的方法加入浓NaOH溶液并加热,产生刺激气味能使湿润的红色石蕊试纸变蓝的气体,则固体为铵盐。
14、某溶液加入H2SO4的同时加入Cu.铜溶解溶液变蓝,该溶液中含有:NO3-
16、王水的成分及特性浓硝酸与浓盐酸1:3体积比混合具有极强的氧化性(溶解金、铂)
2、不能贮存在有磨口玻璃塞的玻璃瓶中的是NaOH、KOH、(Na2SiO3)
碱金属1Na+的焰色K+的焰色黄色紫色(隔蓝色钴玻璃观察)
5、碱金属单质与盐溶液反应(无法置换金属)2Na+2H2O+CuSO4===Na2SO4+Cu(OH)2↓+H2↑
6、碳酸钠、碳酸氢钠的热稳定性比较碳酸氢钠受热易分解
7、碳酸钠、碳酸氢钠的相互转化NaHCO3加热生成Na2CO3Na2CO3溶液中通入过量CO2生成NaHCO3
3、既能溶于盐酸又能溶于NaOH溶液的物质Al、Al2O3、Al(OH)3、NaHCO3、(NH4)2S
6、能发生钝化现象的两种金属两种酸Fe、Al浓硫酸、浓硝酸
1、有颜色的气体Cl2(黄绿色)、NO2(红棕色)、
2、淡黄色的固体Na2O2、S、AgBr、AgI(黄)
3、水溶液显蓝色的含Cu2+的溶液(如CuSO4溶液)
4、水溶液显黄色的含Fe3+的溶液(如FeCl3溶液)
1、有毒的气体H2S、Cl2、SO2、NO2、;CO、NO
2、有刺激性气味的气体HCl、Cl2、SO2、NO2、NH3、
4、不溶于水(能用排水法收集)的气体H2、O2、N2、NO、CO、CH4、C2H4、C2H2
5、不能用排气法收集的气体NO(氧化)、C2H4、CO(密度与空气近似)
6、溶于水显酸性的气体HCl、SO2、NO2、H2S、CO2(能使湿润的蓝色石蕊试纸变红)Cl2(使湿润的蓝色石蕊试纸先变红,后褪色)
9、能用碱石灰干燥的气体不能用碱石灰干燥的气体NH3酸性气体(HCl、SO2、NO2、H2S、CO2、Cl2) 与酸碱和水反应小结
1、金属与酸反应产生气体情况:(1)与酸反应产生H2(2)与酸反应产生SO2(3)与酸反应产生NO2(4)与酸反应产生NO(1)活动性顺序H以前的金属与盐酸、稀硫酸(2)Cu以前(含Cu)的金属与浓硫酸(3)Ag以前(含Ag)的金属与浓硝酸(4)Ag以前(含Ag)的金属与稀硝酸
2、常温下与水反应产生H2的产生O2的产生C2H2的K、NaNa2O2、F2CaC2
3、既能溶于盐酸又能溶于NaOH溶液的物质Al、Al2O3、Al(OH)3、NaHCO3、(NH4)2S
4、既不溶于水、又不溶于强酸的白色沉淀AgCl、BaSO4
5、不能与水反应的酸性氧化物能与水反应的酸性氧化物SiO2CO2、SO2、SO3等
6、能与水反应的碱性氧化物不能与水反应的碱性氧化物K2O、Na2O、BaO、CaO(MgO)CuO、Fe2O3、Al2O3
1、敞口放置质量会增加的溶液敞口放置质量会减少的溶液浓硫酸(吸水)、碱溶液(吸CO2)浓盐酸、浓硝酸、浓氨水(挥发)
2、常采用电解法冶炼的金属常采用热还原法冶炼的金属常采用热分解法冶炼的金属K、Ca、Na、Mg、AlZn、Fe、Sn、Pb、Cu、Hg、Ag
3、合金的定义和性质两种或以上金属或金属与非金属硬度比组分金属高,熔点比各组分低
4、与环境保护有关的知识:(1)酸雨(2)温室效应(3)光化学烟雾(4)破坏臭氧层(5)白色污染(6)水体富氧化(藻类疯长)(7)能保护环境的最好燃料(1)SO2(2)CO2(3)NO2(4)氟氯烃(5)塑料袋(6)含磷洗衣粉(7)H2
5、常见的漂白剂(1)将有色物质氧化的:氯水(实为HClO)、Na2O2、H2O2、O3(2)SO2(与有色物质结合成不稳定无色物)
9、NaCl食盐19KAl(SO4)2?12H2O明矾
10、NaOH烧碱、火碱、苛性钠20CO2固体干冰
3、能使KMnO4酸性溶液褪色的烯、炔(苯、烷不能)
8、属于天然高分子的是淀粉、纤维素、蛋白质、天然橡胶(油脂、麦芽糖、蔗糖不是)

 U633687664
U633687664
 U582679646
U582679646