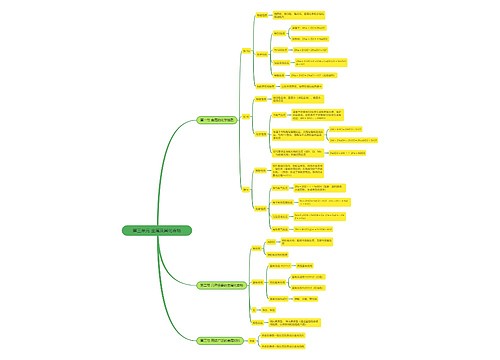
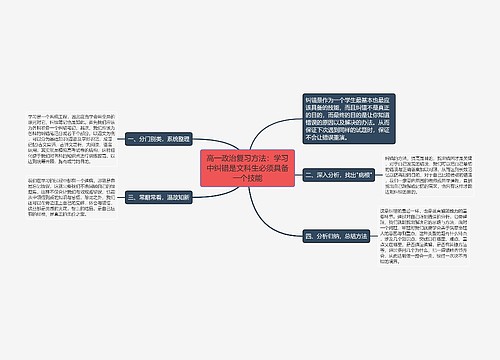
高一化学学习方法:例谈化学计算中的数据迷惑思维导图
你拥我暖
2023-04-20

一、虚设型数据迷惑试题给出的数据是解题不必要的,把本属于概念判断型或规律应用型试题伪装成计算题,这是命题者精心设计的陷阱,
树图思维导图提供《高一化学学习方法:例谈化学计算中的数据迷惑》在线思维导图免费制作,点击“编辑”按钮,可对《高一化学学习方法:例谈化学计算中的数据迷惑》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:7dc63955b0a6891f41adb1057c78adc7
思维导图大纲
相关思维导图模版
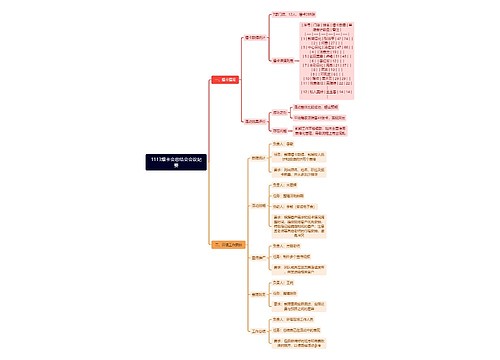
1113爆卡会总结会会议纪要思维导图
 U245265618
U245265618树图思维导图提供《1113爆卡会总结会会议纪要》在线思维导图免费制作,点击“编辑”按钮,可对《1113爆卡会总结会会议纪要》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:aaf6c152a765d5821e8e1787f2b3226e
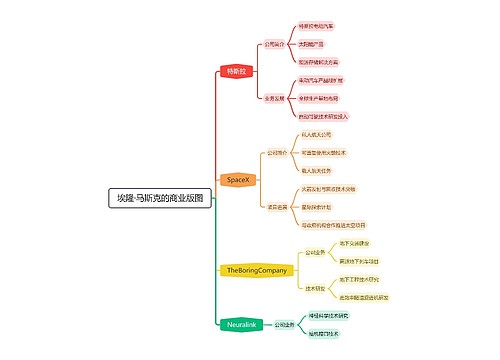
埃隆·马斯克的商业版图思维导图
 乐农
乐农树图思维导图提供《埃隆·马斯克的商业版图》在线思维导图免费制作,点击“编辑”按钮,可对《埃隆·马斯克的商业版图》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:7464362ac911e8a334867bb3fc7a2346