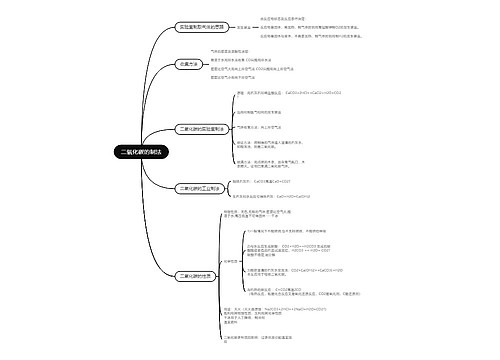
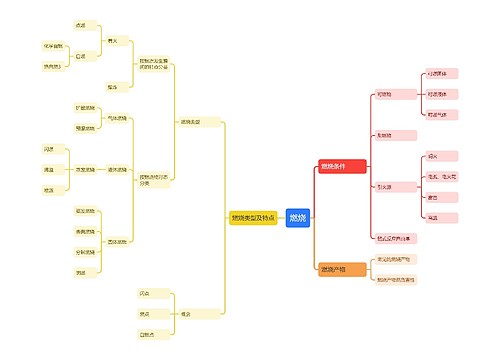
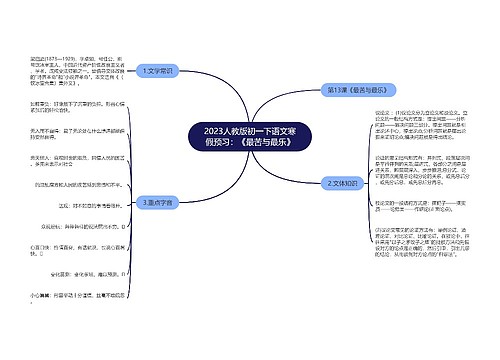
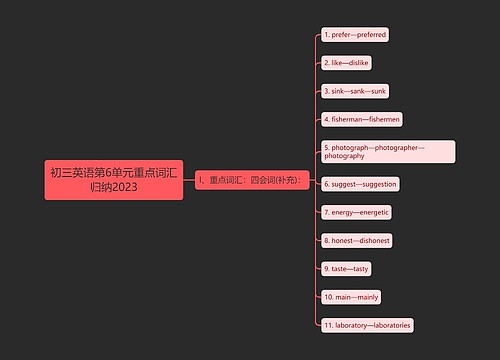
中考化学1:重点模拟试题及参考答案(十二)思维导图
孤败
2023-04-11

新东方中考网为广大中考生整理了中考化学1:重点模拟试题及参考答案(十二),供大家参考学习。
树图思维导图提供《中考化学1:重点模拟试题及参考答案(十二)》在线思维导图免费制作,点击“编辑”按钮,可对《中考化学1:重点模拟试题及参考答案(十二)》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:946746f89862295b45d7d93912136bd6
思维导图大纲
相关思维导图模版
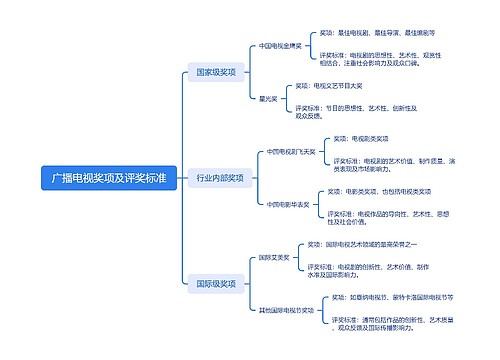
广播电视奖项及评奖标准思维导图
 U782682106
U782682106树图思维导图提供《广播电视奖项及评奖标准》在线思维导图免费制作,点击“编辑”按钮,可对《广播电视奖项及评奖标准》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:a4210651fa3a78355ac9f5101bb2c616
1113爆卡会总结会会议纪要思维导图
 U245265618
U245265618树图思维导图提供《1113爆卡会总结会会议纪要》在线思维导图免费制作,点击“编辑”按钮,可对《1113爆卡会总结会会议纪要》进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:aaf6c152a765d5821e8e1787f2b3226e